Равновесный раствор
Cтраница 3
Наряду с истинными равновесными растворами полимеров легко получить неравновесные растворы, которые в случае достаточно концентрированных систем могут оставаться неравновесными очень длительно. [31]
NaCl в равновесных растворах одинакова. Это означает, что низкомолекулярный электролит NaCl практически не переходит через мембрану. Подобная система может возникнуть и в отсутствие мембраны, например при равновесии раствор - набухший гель, частицы которого связаны друг с другом и не могут свободно диффундировать. [32]
Если в равновесном растворе сахара хотя бы и небольшом количестве содержится таутомерная форма с двумя парами соседних гидроксилов в цис-положении, то в реакцию с ацетоном вступает именно эта форма, в которую постепенно переходят другие таутомеры. [33]
Если в равновесном растворе сахара хотя бы в небольшом количестве со - держится таутомерная форма с Двумя парами соседних гидроксилов в цис-положении, то в реакцию с ацетоном вступает именно эта форма, в которую постепенно переходят другие таутомеры. [34]
Если в равновесном растворе сахара хотя бы в небольшом количестве содержится таутомерная ферма с двумя парами соседних гидроксилов в чис-положении, то в реакцию с ацетоном вступает именно эта форма, в которую постепенно переходят другие таутомеры. [35]
Если в равновесном растворе сахара хотя бы в небольшом количестве содержится таутомерная форма с двумя парами соседних цмс-гид-роксилов, в реакцию с ацетоном вступает именно эта форма, в которую постепенно переходят другие таутомеры. [36]
Определение в равновесном растворе концентрации обменивающихся противоионов и коиона позволяет на этом этапе исследования судить об эквивалентности обмена и постоянстве ( или изменении) концентрации коионов. [37]
Рассмотрим для примера равновесный раствор аммиака в тяжелой воде. В нем находятся молекулы с разными соотношениями изотопов: NH3, NH2D, NHD2 и ND3 для аммиака и Н20, HDO и D20 для воды. [38]
Рассмотрим для примера равновесный раствор аммиака в тяжелой воде. [39]
Данные о составе равновесного раствора позволяют выразить его состав через молярные доли отдельных видов молекул, образующих равновесный раствор. [40]
Данные о составе равновесного раствора позволяют выразить его состав через мольные доли отдельных видов молекул, образующих равновесный раствор. [41]
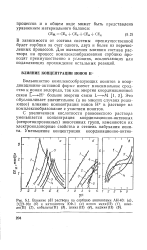 |
Влияние рН раствора на сорбцию анионитами АН-40. ( а, ЭДЭ-Юп ( б и катионитом КФ-1 ( в ионов меди ( П ( /, никеля ( II ( 2, кобальта ( П ( 3, цинка ( II ( 4, кадмия ( II ( 5. [42] |
С увеличением кислотности равновесного раствора уменьшается концентрация координационно-активных ( непротонированных) ионогенных групп, изменяются их электронодонорные свойства и степень набухания иони-та. [43]
Данные о составе равновесного раствора позволяют выразить его состав через мольные доли отдельных видов молекул, образующих равновесный раствор. [44]
В системах, содержащих равновесные растворы, наблюдаемая электродвижущая сила, измеренная с помощью, например, потенциометра, определяющаяся молярными или парциальными молярными свободными энергиями веществ, участвующих в равновесии, оказывается ( см. гл. VI) связанной определенным обраСзом с их активностями, Наоборот, связь между активностью и концентрациями не может быть установлена термодинамически и должна быть определена химическим анализом равновесной системы. [45]
Страницы: 1 2 3 4