Равновесный раствор
Cтраница 2
В равновесном растворе ионные состояния практически не изменяются в течение времени разделения от 5 до 18 мин. [16]
В равновесных растворах полимеров наряду с изолированными макромолекулами ( молекулярный уровень дисперсности), существуют структуры определенных типов, возникающие вследствие агрегации или ассоциации макромолекул. Эти процессы протекают в области концентраций как ниже, так и выше С, что связано с зависимостью параметра взаимодействия полимер - растворитель Хи т концентрации. Взаимодействие клубков в растворах приводит к возникновению агрегатов молекул, представляющих собой роевое образование взаимодействующих друг с другом клубков с определенной продолжительностью жизни. Тип агрегатов и число молекул, входящих в него, определяются природой сил межмолекулярного взаимодействия между макромолекулами, природой растворителя и концентрацией раствора. Термодинамической причиной образования агрегатов может быть неполная термодинамическая совместимость фракций различной молекулярной массы даже одной химической природы. [17]
В равновесном растворе фруктозы содержится довольно большое ( по сравнению с глюкозой) количество оксоформы, а также фураиоз. [18]
В полученном равновесном растворе определяют содержание катионов кальция титрованием проб, отобранных пипеткой на 10 - 25 мл, раствором трилона Б из бюретки. Для этого к 25 мл анализируемого раствора добавляют 1 мл борат-ного буфера и 7 - 8 капель раствора хром темно-синий К. [19]
Исходный и равновесные растворы анализировали на содержание железа титриметрическим бихроматометрическим методом. [20]
NHJgCOa; равновесный раствор отделяют фильтрованием и доводят общий объем фильтрата в мерной колбе до 250 мл. Фильтрат выпаривают на водяной бане досуха. Сухой остаток обрабатывают в фарфоровой чашке 50 % - ным раствором этилового спирта, добавляя его небольшими порциями. В этом реактиве растворимы карбонаты калия и натрия, но не растворяются карбонаты кальция и магния. [21]
По составам равновесных растворов рассчитана ионная сила растворов. Концентрации ионов выражены в молях на 1000 г раствора. [22]
Изменение рН равновесного раствора практически не оказывает никакого влияния на степень сорбции ОП-7 фосфатом кальция. Так как гидрофобные свойства фосфата кальция, представляющего в растворе равновесную смесь средней и кислой соли в исследованном интервале кислотности раствора не изучены, объяснить полученные результаты невозможно. [23]
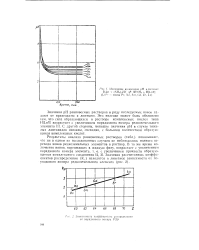 |
Зависимость коэффициента распределения от порядкового номера РЗЭ. [24] |
Значения рН равновесных растворов в ряду исследуемых ионов падают от празеодима к лютецию. Это явление может быть объяснено тем, что сила образующихся в растворе комплексных кислот типа HlLnY ] возрастает с увеличением порядкового номера редкоземельного элемента [ Ц С другой стороны, меньшие значения рН в случае тяжелых лантанидов связаны, очевидно, с большим количеством образующихся комплексных кислот. [25]
Результаты анализа равновесных растворов ( табл.) показывают, что ни в одном из исследованных случаев не наблюдалось полного перехода ионов редкоземельных элементов в раствор. [26]
Проверяют рН водного равновесного раствора при помощи рН - метра или универсального индикатора. Определяют коэффициент распределения 90Sr2 и 90Y3 и коэффициент их разделения. Строят график a f ( pH) и находят, при каком рН получается максимальный коэффициент разделения. [27]
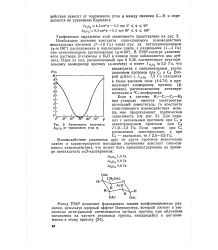 |
Зависимость константы ндн2 от торсионного угла ф. [28] |
В ПМР-спектре равновесного раствора D-глюкозы в D2O в низком поле наблюдаются два дублета. [29]
Добавляя к равновесным растворам растворитель и снова добиваясь установления равновесия, определяли количество необратимо сорбированного модификатора и рассчитывали физическую и химическую сорбцию. [30]
Страницы: 1 2 3 4