Нитробензольный раствор
Cтраница 1
Нитробензольный раствор вместе с суспендированным в нем осадком встряхивают сначала со смесью 300 мл воды и 100 г льда, а затем еще два раза с холодной водой порциями по 100 мл. Соединенные водные вытяжки фильтруют через смоченный фильтр и насыщают при перемешивании 200 г поваренной соли; при этом выделяется в виде бесцветных листочков 2-нафтол - 1-сульфокислый натрий. Перемешивают до тех пор, пока поваренная соль полностью не растворится, оставляют, лучше всего, на ночь и затем отсасывают, дважды заливая насыщенным раствором поваренной соли. [1]
 |
Константы равновесия реакции алкоголиза гетрахлоридов циркония и гафния в метиловом и этиловом спиртах. [2] |
В нитробензольных растворах тетрахлориды циркония и гафния реагируют с метиловым спиртом с образованием молекулярных соединений ZrQ4 2СН3ОН и ШС14 2СНЯОН, возможно, сольватиро-ванных нитробензолом [ ПО, 113 ]; реакций алкоголиза в этих растворах не наблюдается. [3]
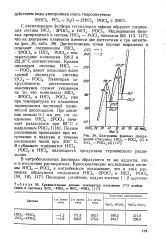 |
Диаграммы фазовых превращений в системах HfCl - POC1, ( / и ZrCl4 - РОС13 ( 2.| Сравнительные данные температур плавления ( С особых точек в системах ZrCl4 - РОС13 и ШС1 - РОС13. [4] |
В нитробензольных растворах образуются те же аддукты, что и в отсутствие растворителя. [5]
Различие между метаноль-ными и нитробензольными растворами можно объяснить образованием водородной связи между метанолом и бромид-ионом, однако не очевидно, может ли нитрометан вообще в значительной степени ассоциироваться с каким-нибудь ионом. Хайн [32] предполагает, что нитробензол сдецифически взаимодействует с ионной парой. Все три растворителя имеют примерно равные диэлектрические проницаемости. [6]
Получается хлорированием изовиолантрона в нитробензольном растворе или действием щелочи на дихлорбензантрон. [7]
Хлористый алюминий образует в нитробензольном растворе комплексное соединение с амидами состава 1: 1, которое находится в равновесии с нитробензольным комплексом хлористого алюминия. Равновесие смещено в сторону более устойчивого амидного комплекса. [8]
Молярное преломление хлористого алюминия в нитробензольном растворе отличается от той же величины, найденной в водном растворе и в твердых солях, что наводит на мысль об образовании комплексов с растворителями. [9]
Ход кривых удельного веса и вязкости нитробензольных растворов хлористого алюминия, содержащих мочевину, примерно одинаковый с растворами ацетамида. В этой точке кривая имеет излом, соответствующий более быстрому нарастанию вязкости системы с увеличением концентрации амида. [10]
Пирен хлорируется с большой легкостью в нитробензольном растворе, при действии молекулярного хлора образуя 1 3 6 8-тет-рахлорпирен, выпадающий в осадок. [11]
В результате ацетилирования метилового эфира в нитробензольном растворе по Фриделю и Крафтсу образуются два изомера, являющиеся 6 - и 8-ацетопроизводными, что доказано их окислением азотной кислотой в пиромеллитовую и, соответственно, пренитовую кислоты; 8-ацетогруппа испытывает, очевидно, значительные пространственные затруднения, так как этот изомер не образует оксима. Сплавление со щелочью вызывает глубокое расщепление и дегидрирование сульфодегидроабиетиновой кислоты, но 6-амино - и 6-оксидегидроабиетиновые кислоты удалось получить с удовлетворительными выходами через 6-ацетопроизводное и таким образом установить их строение. Амино - и 6-оксипроизводные могут быть получены более коротким и более удобным путем, исходя из сульфокислоты, через соответствующее бромпроизводное, и эти реакции выявляют положение сульфогруппы. Строение динитропроизводного устанавливается как на основании приведенных в схеме превращений, так и на основании наблюдения, что оно обладает свойствами мета-динитро-производного. [12]
Определена растворимость ацетамида и мочевины в нитробензольных растворах хлористого алюминия. [13]
Измерены при 18 удельный вес и вязкость нитробензольных растворов хлористого алюминия до концентрации 20.14 % вес. [14]
Жидкостной бромид-селективный электрод, изготовленный на основе нитробензольного раствор. Лучшими характеристиками обладает электрод со смесью ( Кристаллического фиолетового ( 5 - 10 - 3М) и бромида ртути ( нас. Присутствующие в растворе ионы калия, кальция, бария, мягния, меди, железа, хрома не оказывают влияния на электродный потенциал. [15]
Страницы: 1 2 3 4