Водный раствор - кислота
Cтраница 4
 |
Прибор для наблюдения электропроводности растворов. [46] |
Электропроводность водных растворов кислот, оснований и солей объясняет теория электролитической диссоциации. [47]
Свойства водных растворов кислот и оснований определяются теми ионами, на которые они диссоциируют. [48]
Способность водных растворов кислот протонировать основания, как это выражается функцией Я0, увеличивается намного быстрее, чем стехио-метрическая концентрация минеральной кислоты. Кроме того, если концентрацию выразить в единицах моляльности минеральной кислоты, то Н0 для раствора с заданным содержанием воды почти не зависит от природы аниона кислоты. Эти факты подтверждают, что кислотность Н0 тесно связана с природой протона в сильнокислых растворах и, естественно, с активностью воды, которая должна обеспечивать сольватацию протона. Можно предположить, что эта зависимость нарушается в концентрированных кислотах, где количество воды уже недостаточно для существования тетрагидрата протона. Протон ассоциируется со все меньшим числом молекул воды, в результате чего такие протон - содержащие соединения становятся все более сильными кислотами. [49]
Для водных растворов кислот и щелочей подсчет теплоемкости по правилу смешения приемлем только при незначительных концентрациях, так как кислоты и щелочи при растворении их в воде претерпевают глубокие физико-химические изменения. [50]
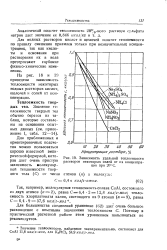 |
Зависимость удельной теплоемкости растворов некоторых солей от их концентрации при 20 С. [51] |
Для водных растворов кислот и щелочей подсчет теплоемкости по правилу смешения приемлем только при незначительных концентрациях, так как кислоты и основания при растворении их в воде претерпевают глубокие физико-химические изменения. [52]
Для водных растворов кислот и щелочей подсчет теплоемкости по правилу смешения приемлем только при незначительных концентрациях, так как кислоты и основания при растворении их в воде претерпевают глубокие физико-химические изменения. На рис. 10 приведена зависимость теплоемкости некоторых водных растворов кислот, щелочей и солей от концентрации. [53]
Страницы: 1 2 3 4