Водный раствор - перекись - водород
Cтраница 3
Митчел и Уинн-Джонс [121] сравнили водные растворы перекиси водорода с водными растворами спирта, доказывая на основании избыточных термодинамических свойств, что перекись водорода легко может внедряться в структуру воды и стягивать ее, тогда как спирт в структуру воды внедриться не может. Аналогично молекула перекиси водорода, находясь в окружении молекул воды, теряет значительную часть кислотности и не может функционировать как кислота в такой же степени, как в свободном состоянии. [31]
Катализаторами, ускоряющими разложение даже водных растворов перекиси водорода на воду и кислород, являются главным образом металлы и их окиси. Незначительного количества губчатой или коллоидной платины достаточно для разложения большого количества перекиси водорода. Перекись водорода взрывается при встряхивании, если находится в концентрированном состоянии или если в ней есть пылинки. [32]
Многие вещества, растворенные в водных растворах перекиси водорода, надолго задерживают ее разложение. Подобное действие оказывают кислоты, ортофосфат натрия и некоторые органические вещества, например салицилат натрия и фенацетин. Такие вещества используются в технике для стабилизации перекиси водорода. [33]
Следы тонкоизмельченной платины, внесенной в водные растворы перекиси водорода, вызывают бурное выделение кислорода. Очень концентрированные растворы перекиси водорода иногда сильно взрывают при попадании в них пылинок. Медленное разложение перекиси водорода происходит уже под влиянием следов щелочи, которые попадают в раствор вследствие растворения стекла. Поэтому совершенно чистые ( без всяких добавок) растворы перекиси водорода сохраняют в парафинированных сосудах. Также и некоторые органические вещества вызывают разложение перекиси водорода. Получающиеся в результате жизнедеятельности организмов вещества, обладающие специфическим свойством разлагать перекись водорода, называются ката-лазами. Такие каталазы находятся, например, в крови и в слюне. [34]
Следы тонкоизмельченной платины, внесенной в водные растворы перекиси водорода, вызывают бурное выделение кислорода. Очень концентрированные растворы перекиси водорода иногда сильно взрывают при попадании в них пылинок. Медленное разложение перекиси водорода происходит уже под влиянием следов щелочи, которые попадают в раствор вследствие растворения стекла. Поэтому совершенно чистые ( без всяких добавок) растворы перекиси водорода сохраняют в парафинированных сосудах. [35]
Следы тонкоизмельченной платины, внесенной в водные растворы перекиси водорода, вызывают бурное выделение кислорода. Очень концентрированные растворы перекиси водорода иногда сильно взрывают при попадании в них пылинок. Медленное разложение перекиси водорода происходит уже под влиянием следов щелочи, которые попадают в раствор f вследствие растворения стекла. Поэтому совершенно чистые ( без всяких добавок) растворы перекиси водорода сохраняют в парафинированных сосудах. [36]
Наибольшее распространение в ракетной технике имеют водные растворы перекиси водорода 80 и 90 % концентрации. [37]
На основе полученных данных охарактеризован состав водных растворов перекиси водорода при различных рН в изученном интервале температур. [38]
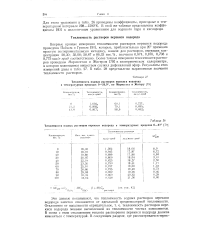 |
Теплоемкости водных растворов перекиси водорода в температурных пределах 0 - 27. [39] |
Эти данные показывают, что теплоемкость водных растворов перекиси водорода заметно отклоняется от идеальной среднемолярной теплоемкости. В связи с этим отклонением теплота растворения перекиси водорода должна изменяться с температурой. [40]
Имеется ряд работ по определению плотности жидких водных растворов перекиси водорода при комнатной температуре, однако надежные исследования, относящиеся IK области высоких концентраций перекиси, появились лишь с 1950 г. Основную трудность при измерениях плотности обусловливает появление пузырьков - кислорода, выделяющихся из концентрированных растворов на поверхности деталей приборов. Только в работах [ 197, 209а, 228 ] приняты действенные меры для устранения этого явления. [41]
Дана термодинамическая характеристика реакций образования и разложения водных растворов перекиси водорода. [42]
 |
Принципиальная схема установки каталитического окисления газовых выбросов по-ливинилформаля. [43] |
Способ обезвреживания гидразингидрата основан на хемосорб-ции его водным раствором перекиси водорода. Технологические выбросы обезвреживаются, проходя через гидрозатвор при каждом аппарате, заполненный 2 - 5 % - ным раствором перекиси водорода. [44]
 |
Производство синтетического глицерина ( новый путь. [45] |
Страницы: 1 2 3 4