Анализируемый водный раствор
Cтраница 2
В присутствии мешающих элементов ( Fe, Th, Zr) к анализируемому водному раствору прибавляют комплексен III из расчета по 10 мг на 1 мл водного раствора. Из объединенных экстрактов уран реэкстрагируют 20 мл 5 % - ного раствора карбоната аммония. Ошибка определения не превышает 2 %, а продолжительность одного анализа - не более 1 часа. [16]
Например, открываемый минимум ионов К, осаждаемых пла-тинохлористоводородной кислотой в виде K2 [ PtCl6 ] в одной капле анализируемого водного раствора, равен 0 1 мкг. [17]
 |
Схема разделения Cu2, Fc3 и А13 методом осадочной хроматографии. [18] |
В центр листа бумаги, пропитанной раствором осадителя - ферроцианида калия K4 [ Fe ( CN) 6 ], капилляром наносится анализируемый водный раствор. [19]
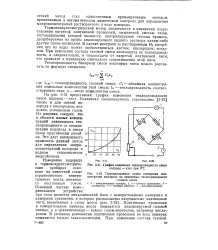 |
График изменения теплопроводности смеси водород - азот при 0 С.| Принципиальная схема измерения концентрации водорода по изменению теплопроводности газовой смеси. [20] |
Термокондуктометрический метод заключается в измерении сопротивления нагретой платиновой проволоки, омываемой смесью газов, составляющими которой являются контролируемая газовая примесь, десорбируемая из пробы анализируемого водного раствора каким-либо другим газом-носителем. В случае контроля за растворенным Hz десорбция его из воды может осуществляться азотом, кислородом, воздухом. При изменении состава газовой смеси изменяются ее теплопроводность, а следовательно, и теплоотдача от нагретой платиновой нити, что приводит к изменению омического сопротивления этой нити. [21]
Данный электрод позволяет измерять концентрацию перхлорат-ионов непосредственно. Анализируемые водные растворы не должны содержать органических соединений во избежание загрязнения или растворения активной фазы. [22]
Титрование в неводном растворе проводят так. Анализируемый водный раствор уксуснокислого натрия, содержащий около 0 2 г этой соли, выпаривают в фарфоровой чашке на водяной бане досуха. Сухой остаток растворяют в 20 - 25 мл смешанного растворителя. [23]
Гидроксид алюминия нерастворим в средах с нейтральным рН, поэтому ион А13 не входит в число естественных примесей природных вод, однако может содержаться в них из-за попадания в речную воду промышленных отходов. В анализируемый водный раствор предварительно добавляют избыток фторид-ионов, которые образуют с А13 комплексный анион A1FJT, после чего раствор встряхивают со слабокислотной карбоксильной смолой. За исключением А1 ( Ш) все остальные ионы металлов поглощаются смолой. [24]
К анализируемому водному раствору фенола прибавляли концентрированной соляной кислоты такое количество, чтобы получился раствор - 5 % НС1 ( брали 25 мл НС1 на 500 мл пробы) и трехкратно экстрагировали фенол эфиром. [25]
Явление концентрационной поляризации было использовано чешским академиком Я - Гейровским для создания нового метода анализа, получившего широкое распространение. Этот метод, называющийся полярографией, основан на электролизе анализируемых водных растворов в ячейке, катодом которой служит ртутный капельный электрод. Метод основан на том, что предельный ток диффузии при поляризации связан с концентрацией разряжающихся ионов. [26]
Анализируемый объект может представлять собой либо твердое вещество ( одна твердая фаза или смесь нескольких твердых фаз), либо водный раствор - с осадком или без осадка. Возможны, конечно, и растворы в неводных растворителях, однако анализируемые водные растворы на практике встречаются намного чаще, чем растворы в неводных растворителях. [27]
В результате абсолютного экстракционного концентрирования повышается концентрация определяемых элементов, так как их из большого объема водной фазы переводят в меньший объем органического растворителя. Нередко такое концентрирование эффективнее и проще, даже чем обычное упаривание анализируемого водного раствора. Осуществление его возможно, если коэффициенты распределения выделяемых микроэлементов достаточно велики. [28]
Результаты предварительных исследований показали, что термические условия в аргоновой плазме не позволяют получить достаточно высокую степень диссоциации термостойких соединений, вводимых в факел в виде водных растворов. Для повышения газовой температуры плазмы рассмотрены два пути - введение добавки пропана к аргону ( Z % по объему) и добавки органических растворителей ( изоцропилового спирта) к анализируемому водному раствору. Достигнутый уровень газовой температуры - 4800 - 5000 КГ а также снижение концентрации атомов кислорода в плазме позволило достигнут высокой степени диссоциации даже наиболее термостойких моноокисей. В табл. 2 приведены сравнительные данные по чувствительности определения элементов ( чувствительность оценивалась в мкг / мл на уровне 1 % поглощения) при использовании ВЧФР и горючих газов. [29]
Анализируемый водный раствор объемом 0 02 мл наносили на диск, подсушивали под инфракрасной лампой и помещали в кратер нижнего электрода, который служил анодом дуги постоянного тока. [30]
Страницы: 1 2 3