Сульфидный раствор
Cтраница 3
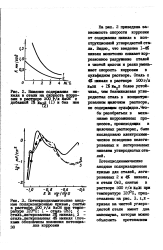
Функция экспериментально выполняется в соответствии с уравнением Нернста ( dE / d gas 29 6 мВ при 25 С) в интервале от Ю-2 до 10 - 7М в сильнощелочных сульфидных растворах. [31]
Сульфидный раствор, выходящий по линии 12, подают для выпаривания в кристаллизационный аппарат 7, в котором происходит осаждение кристаллического хлорида натрия. В сульфидном растворе 14, выходящем из кристаллизационного аппарата, концентрация хлорида натрия может быть снижена до 4 %; при этом концентрация сульфида натрия возрастает до 25 % и осаждения кристаллов сульфида натрия не происходит. Кристаллический материал 13 содержит ряд примесей, прежде всего карбонат и сульфат натрия. [32]
Из содового сепаратора смесь, содержащая большое количество сульфида, по линии / / подается в аппарат для подщелачивания 5, в котором происходит удаление остатков карбоната, хотя эта стадия и не является обязательно необходимой. Обычно в аппарате 5 сульфидный раствор обрабатывают известью; при добавлении больших количеств извести достигается полное протекание реакции. [33]
Разработаны способы получения гидроокиси бария из щелоков BaS119 или из растворов хлорида, нитрата или ацетата бария129 с помощью сильнокислотных ( К - или Ыа - форма) или сильноосновных ( ОН - - форма) ионитов, которые регенерируют растворами едких щелочей. Для сорбции бария из сульфидных растворов рекомендуется фильтровать его через катионит К. [34]
Эффективным катализатором являются селеносульфидные ионы, получающиеся при растворении селена в щелочных сульфидных растворах. Этой реакцией можно обнаружить также селенит-ион, поскольку в данных условиях он восстанавливается до селена. [35]
В последние годы применительно к электродам с твердыми мембранами обсуждаются вопросы чувствительности их при низких активностях. Морф, Кар и Симон [265] наблюдали отклонения от нормального значения в разбавленных сульфидных растворах потенциала для Ag2S - элeктpoдa и в иодидных растворах для Agl-электрода. Эти отклонения связаны с различными процессами, в частности с адсорбцией общего с солью иона. [36]
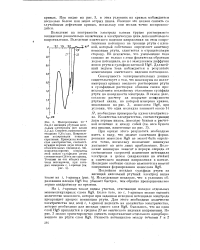
На рис. 2 приведена зависимость скорости коррозии от содержания никеля в конструкционной углеродистой стали. Видно, что введение I-4 & никеля монотонно снижает коррозионное разрушение сталей в чистой щелочи и резко уменьшает скорость коррозии в сульфидном растворе. Сталь с 4& никеля в растворе 500 г / л НаОН 1 % MagS более устойчива, чем безникелевая углеродистая сталь в концентрированном щелочном растворе, не содержащем сульфидов. Чтобы разобраться в механизме коррозионных процессов, происходящих в щелочных растворах, было исследовано электрохимическое поведение нелегированных и легированных никелем углеродистых сталей. [38]
Сорбция серы пермутитами представляет собой яркий пример реакции адсорбции. Химические условия здесь, однако, более сложны, чем они могут показаться; во-первых, происходит анионный обмен, вследствие которого ионы гидроксила обмениваются на гидросернистые ионы SH - из сульфидного раствора. В пермутитах, лишенных воздуха, два поглощенные атома серы точно приходятся на утроенную формулу пермутита. В то время как этот анионный обмен является типичной ионной реакцией и происходит мгновенно, окисление сульфогид-рата до полисульфида кислородом воздуха и окрашивание в синий цвет протекают гораздо медленнее. Сера адсорбируется пермутитом, но не в стехиометрическом отношении. [39]
Патина, использующаяся для окрашивания металлов, применяется в холодном или горячем виде. Свинец и соединения мышьяка в любой форме являются очень токсичными, другие вещества также могут выделять токсичные газы при нагревании. Растворы ферроцианида калия выделяют при нагревании цианид водорода, растворы мышьяковой кислоты - арсин, сульфидные растворы - сульфид водорода. Следует избегать соединений мышьяка и нагревания растворов ферроцианида калия. [40]
В этой связи заслуживает упоминания работа Грэма [23], в которой адсорбируемость большого числа неорганических анионов на ртути сопоставлена с растворимостью соответствующих солей ртути. Сульфид-ионы в этой работе не рассмотрены. Если, однако, закономерность, подмеченную Грэмом, применить к сульфид-ионам, то получаются невероятно высокие значения емкости для сульфидных растворов. Из зависимости потенциалов нулевого заряда ртути от произведений растворимости, построенной по имеющимся в литературе данным [10], также получается чрезмерно высокое значение потенциала нулевого заряда для ртути в контакте с сульфидным раствором. Возможно, причина этого заключается в том, что указанные закономерности для одновалентных ( галоидных, CN - -, CNS -) и двухвалентных анионов различны. [41]
В этой связи заслуживает упоминания работа Грэма [23], в которой адсорбируемость большого числа неорганических анионов на ртути сопоставлена с растворимостью соответствующих солей ртути. Сульфид-ионы в этой работе не рассмотрены. Если, однако, закономерность, подмеченную Грэмом, применить к сульфид-ионам, то получаются невероятно высокие значения емкости для сульфидных растворов. Возможно, причина этого заключается в том, что указанные закономерности для одновалентных ( галоидных, CN -, GNS -) и двухвалентных анионов различны. [42]
В этой связи заслуживает упоминания работа Грэма [23], в которой адсорбируемость большого числа неорганических анионов на ртути сопоставлена с растворимостью соответствующих солей ртути. Сульфид-ионы в этой работе не рассмотрены. Если, однако, закономерность, подмеченную Грэмом, применить к сульфид-ионам, то получаются невероятно высокие значения емкости для сульфидных растворов. Из зависимости потенциалов нулевого заряда ртути от произведений растворимости, построенной по имеющимся в литературе данным [10], также получается чрезмерно высокое значение потенциала нулевого заряда для ртути в контакте с сульфидным раствором. Возможно, причина этого заключается в том, что указанные закономерности для одновалентных ( галоидных, CN - -, CNS -) и двухвалентных анионов различны. [43]
Появление на поверхности электрода пленки трудно растворимого соединения равносильно включению в электрическую цепь дополнительного сопротивления. Вследствие омического падения напряжения на этом сопротивлении потенциал на границе ртути с плен-кой, который собственно определяет кинетику ионизации ртути, сдвигается в отрицательную сторону. Но исключено, что уменьшение тока связано не только с этим фактически обратным ходом потенциала, но и с замедлением диффузии ионов ртути и сульфида пленкой HgS. Дальнейший подъем тока наблюдается в результате компенсации омического падения потенциала. Совокупность экспериментальных данных свидетельствует о том, что максимумы па вольт-амперных кривых анодного растворения ртути в сульфидных растворах обязаны своим происхождением послойному отложению сульфида ртути на поверхности электрода. [45]
Страницы: 1 2 3 4