Растворение - титан
Cтраница 1
Растворение титана ведут при нагревании. Добавляют в воронку растворы метабисульфита, пиридина, йодистого калия и далее производят экстракцию и определение сурьмы, как описано выше. [1]
Растворение титана в области концентрации серной кислоты 75 - 90 вес. В этой области концентраций имеют место интенсивные окислительно-восстановительные процессы, так как крепкая серная кислота является сильным окислителем, а ионы Ti2 и Ti3 - энергичными восстановителями. [2]
После растворения титана добавляют по каплям концентрированную азотную кислоту до обесцвечивания раствора и выпаривают до появления белых густых паров серной кислоты. Раствор после охлаждения переводят в мерную колбу емк. [3]
Скорость растворения титана в пассивной области практически не зависит от потенциала и резко возрастает при повышении концентрации плавиковой кислоты. Скорость коррозии сплава при f 0 7в линейно возрастает в интервале концентраций плавиковой кислоты 1 0 - 2 5 н, как будто растворение сплава ъ области перепассивации является реакцией первого порядка по плавиковой кислоте. [4]
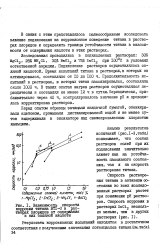 |
Зависимость скорости. [5] |
Скорость растворения титана в активном состоянии во всех исследованных растворах растет при понижении рН растворов. [6]
При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с максимальной степенью окисления. [7]
При растворении титана в корунде происходит изотропное деформирование решетки корунда: деформацию претерпевает весь материал. [8]
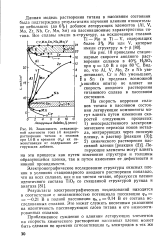 |
Зависимость стационарной плотности тока ( I анодного растворения титана и сплавов при 1 0В и времени ( та их самоактивации от содержания легирующих добавок. [9] |
Данная модель растворения титана в пассивном состоянии была подтверждена результатами изучения влияния относительно небольших ( до 6 %) добавок легирующих элементов ( А1, V, Mo, Zr, Mb, Cr, Mn, Sn) на пассивационные характеристики титана. [10]
На скорость растворения титана в азотной кислоте не влияет контакт с другими металлами. [11]
Исследование кинетики растворения титана в соляной кислоте, проведенное в работе Осука [50], показало, что оно протекает с торможением во времени ( фиг. [12]
Сопоставление скорости растворения титана при стационарном потенциале со скоростью растворения при потенциалах в области устойчивой пассивности показывает, что анодная защита позволяет снизить скорость коррозии в 15 - 30 раз. Плотность анодного тока в данном случае не может служить количественной характеристикой коррозионного процесса, поскольку одновременно осуществляется процесс анодного окисления ионов Сг2 до Сг3, скорость которого в 85 раз превышает скорость растворения титана в области устойчивой пассивности. [13]
Изучена кинетика растворения титана и его сплавов в азотной кислоте без фторидов и в их присутствии при 20ч - 200 С и 1ч - 15 ата. Исследованные металлы корродируют из пассивного состояния, при увеличении температуры и содержания F - ионов токи растворения и скорости коррозии монотонно возрастают, а при увеличении концентрации кислоты проходят через максимум. [14]
Уменьшения скорости растворения титана при смещении анодного потенциала электрода в положительную сторону при низких частотах, как это наблюдалось в растворах серной кислоты, в данном случае не происходит, так как присутствующие в растворе ионы хлора, очевидно, препятствуют образованию на поверхности металла сплошной пассивирующей окисной пленки. Если при прочих равных условиях сравнить коррозионные эффекты на титане в 10 N растворе H2S04 и в 10 N растворе HG1 при одних и тех же значениях анодного потенциала ( см. рис. 3 и 5), то оказывается, что скорость растворения титана в 10 N НС1 значительно выше ( особенно при низких частотах), чем в серной кислоте той же концентрации. [15]
Страницы: 1 2 3 4