Растворение - титан
Cтраница 3
В целом обеднение-стальной связки легирующими элементами и растворение титана в ней приводят к негативным последствиям. Так как карбид титана, обычно используемый в производственных условиях, имеет некоторый дефицит по связанному углероду, наблюдается обезуглероживание жидкой стали при спекании. Термическая обработка карбидосталей в этом случае не дает нужного эффекта, потому что безуглеродистый мартенсит не обладает высокой твердостью. [31]
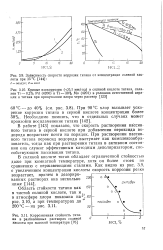
Имеется много фактов, подтверждающих развиваемую модель растворения пассивного титана. Действительно, одинаковый структурный состав барьерных слоев, образующихся при различных потенциалах, не позволяет объяснить значительное снижение анодных токов ( почти на 2 порядка), наблюдаемое при повышении потенциала от 0 14 до 1 4 В ( рис. 8), изменением скорости растворения этих слоев. Основной причиной снижения стационарных анодных токов является уменьшение ионной проводимости пассивных пленок вследствие снижения их дефектности. Можно полагать, что дефектность пленок уменьшается с ростом потенциала до некоторого значения ( ф 1 4 В), после чего меняется несущественно. Перегиб кривой ( рис. 8) происходит вблизи равновесного потенциала кислородного электрода. Очевидно, по мере приближения потенциала титана к равновесному кислородному, количество адсорбированного кислорода ( в виде ионов ОН - или 0 -) возрастает. Это, по-видимому, и является причиной уменьшения дефектности пленок, и, как следствие, снижения тока растворения титана. [32]
В работе [101] показано, что скорость растворения пассивного титана в серной кислоте при добавлении перекиси водорода возрастает почти на порядок. При растворении пассивного титана перекись водорода выступает как комплексообразова-тель, тогда как при растворении титана в активном состоянии она служит эффективным катодным деполяризатором, способствующим пассивации титана. [34]
Имеется много фактов, подтверждающих рассматриваемую модель растворения пассивного титана. Действительно, одинаковый структурный состав барьерных слоев, образующихся при различных потенциалах, не позволяет объяснить значительное снижение анодных токов ( почти на 2 порядка), наблюдаемое при повышении потенциала от 0 14 до 1 4 В ( см. рис. 2.12), изменением скорости растворения этих слоев. [35]
В работе [143] показано, что скорость растворения пассивного титана в серной кислоте при добавлении пероксида водорода возрастает почти на порядок. При растворении пассивного титана пероксид водорода выступает как комплексообра-зователь, тогда как при растворении титана в активном состоянии она служит эффективным катодным деполяризатором, способствующим пассивации титана. [37]
В 58 % - ном растворе серной кислоты растворение титана в начальный период протекает более интенсивно, чем в 40 % - ной H2SO4, но после 3 - 4 ч сильно затормаживается, а через 8 - 10 ч почти совершенно прекращается. [38]
В присутствии даже небольших количеств ионов фтора скорость растворения титана увеличивается [85, 86], что наблюдается также и на электродах из гидрида титана. [39]
Из поляризационных кривых установлено, что наименьшая скорость растворения титана в пассивной области при рН - 9 - 11, но область пассивации незначительная. При рН 3 - 6 скорость коррозии несколько увеличивается, но границы устойчивого состояния потенциалов увеличиваются значительно. Это дает возможность работать в большем интервале потенциалов при незначительной скорости коррозии титана. [40]
В [94] показано, что и в стационарных условиях растворение пассивного титана происходит, главным образом, путем непосредственного электрохимического перехода катионов титана в раствор. В этих исследованиях образцы титана предварительно подвергали активации потоком тепловых нейтронов. [41]
Показано, что в 10 N растворе НС1 скорость растворения титана под действием переменного тока при всех исследованных частотах значительно выше, чем в серной кислоте той же концентрации, что объясняется активирующим действием хлор-ионов. [42]
Рост скорости окисления при малых концентрациях титана связан с растворением титана в NiO. В состав окалины кроме NiO, NiCr2O4 и Сг2О3 входят NiTiO3 и рутил, причем концентрация последних с течением времени возрастает. [43]
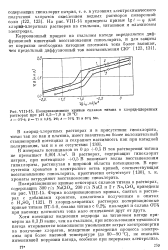 |
Поляризационные кривые сплавов титана в хлорид-хлоратных. [44] |
В интервале потенциалов от 0 до 0 5 В ток растворения титана не превышает 0 001 А / ма. В растворах, содержащих гипохлорит натрия, при потенциале 0 5 В возникает волна восстановления гипохлорита, растянутая в широкой области потенциалов. [45]
Страницы: 1 2 3 4