Растворение - углеводород
Cтраница 3
Полученные приближенным расчетом положительные значения изменения энтальпии ( 1 - 5 ккал / молъ) при внутримицеллярном растворении углеводородов в растворах всего ряда исследованных мыл в данном интервале температур позволяют заключить, что сама по себе солюбилизация углеводородов в водных растворах мыл, оставаясь ограниченной равновесной величиной, носит в основном энтропийный характер. [31]
Трудность сульфирования ароматических углеводородов возрастает с увеличением длины и количества боковых цепей; то же относится и к растворению углеводородов в серной кислоте. [32]
Приведенные там константы основности углеводородов предусматривают те атомы углерода в молекуле, к которым может присоединиться протон при растворении углеводорода в жидком HF. В табл. 51 они отмечены точками. Надо иметь в виду, что в некоторых углеводородах ( например, в толуоле, дифениле) атомы углерода, помеченные как равноценные, в действительности отличаются по своей способности присоединять протон. В этом можно убедиться, например, сравнивая факторы парциальной скорости дейтерообмена с жидким НВг для орто - и пара-атомов водорода в названных веществах ( стр. Однако применительно к растворам в жидком HF пометку надо считать правильной, так как в этом растворителе очень нивелируются различия в силе оснований. [33]
В этой работе нами рассматривается применимость правила В. К. Семенченко ( Журнал физической химии, № 2, 1948) к случаям растворения углеводородов в полярных и неполярных растворителях. [34]
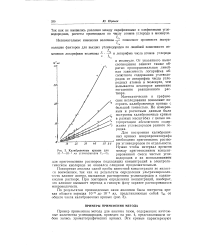 |
Калибровочные кривые для Ю-6-К-4 мл углеводородов Q-Cs. [35] |
Повторение анализа одной пробы известной концентрации не является возможным, так как на результаты определения ультрамикроколи-честв влияют потери, вызванные растворением углеводородов в солянокислом растворе. При повторном определении концентраций, наоборот, это влияние вызывает переход в газовую фазу заранее растворившихся микроколичеств. [36]
ДЭГ; Цк - от выделения тепла п; i конденсации водяного пара и растворения конденсата в гликоле; Q - от ястичного растворения углеводородов в гликоле; правая - расходу тепла ( кВт): Q. [37]
Для проведения хамелеоновой пробы 2 - 3 см3 испытуемого продукта вносят в пробирку, куда приливают двойное количество химически чистого ацетона ( для растворения углеводородов) и прибавляют одну каплю 1 % - ного водного раствора марганцевокислого калия. Одновременно пускают секундомер и наблюдают за цветом раствора. Останавливают секундомер в момент, когда малиновый цвет перейдет в красный, и отмечают время, в течение которого продукт держит хамелеоновую пробу. Для более удобной отметки момента перемены окраски предварительно приготовляют эталонный раствор, с которым сравнивают испытуемый. В качестве эталона служит ацетон или дистиллированная вода с каплей раствора, помещенные в пробирку такого же диаметра, как и пробирка с испытуемым продуктом. [38]
И в том случае, когда в молекуле отсутствует гидрофильная группа, как это имеет место для углеводорода, энтропии разведения противостоит теплота растворения углеводорода. [39]
Эти результаты в сочетании с результатами температурной зависимости ККМ, реологических характеристик в соответствующих сопряженных системах, а также полученные приближенным расчетом небольшие положительные значения энтальпии внутримицеллярного растворения углеводородов ( ДЯ от 1 до б ккал / моль) в данном интервале температур позволяют заключить, что сама по себе солюбилизация углеводородов в водных растворах мыл, оставаясь ограниченной равновесной величиной, носит в основном энтропийный характер. Далее работами этих же сотрудников было показано, что коллоидная растворимость, определяясь в значительной степени мицеллярной структурой растворов поверхностно-активного полуколлоида, в свою очередь оказывает на нее резкое влияние. Такое влияние выражено тем более сильно, чем выше концентрация раствора. При этом солюбилизация углеводородов оказывает резкое разжижающее действие с понижением, например в растворах олеата натрия, наибольшей предельной вязкости в сотни тысяч раз, по-видимому, вследствие обратного превращения слоистых мицелл в сфероидальные стабилизованные мицеллы, не обладающие коагу-ляционными контактами на своей поверхности. [40]
Таким образом, природа сил, обусловливающих растворение углеводородов в водных растворах мыл ниже ККМ и гидротропного агента - бу-тирата натрия, одинакова, о чем свидетельствует близкий порядок величин теплот растворения углеводородов в этих растворах, зависящий только от природы углеводорода. [41]
Такое определение следует проводить при заполнении пустого баллона из каждой новой партии сжиженного газа, а исследование первых 5 л газа, извлеченных из этого баллона, надо выполнять по методу, основанному на растворении углеводородов технического сжиженного газа в безводной уксусной кислоте и измерении количества оставшегося газа. [42]
Действительно, как показали слектры ЯМР, в водных растворах вблизи молекул углеводородов период релаксации молекул воды в два раза больше, чем в воде, не содержащей растворенных углеводородов. Растворение углеводорода в воде приводит к равномерному распределению его молекул и, следовательно, к росту энтропии, однако из-за низкой растворимости углеводородов это увеличение энтропии не может компенсировать понижение энтропии системы, обусловленное структурированием воды в таком растворе. Уменьшение энтропии компенсирует процесс, ведущий к уменьшению границы контактов углеводородных цепей с водой, - ассоциацию углеводородных радикалов молекул ПАВ. В результате такой ассоциации уменьшается доля жидкости с повышенной структурированностью, и абсолютная величина понижения энтропии в растворе углеводородов или ПАВ становится равной абсолютной величине прироста энтропии, вызванного растворением углеводородов. Если в воде растворен углеводород, это явление ограничивает его растворимость и приводит к появлению углеводородной макрофазы ( жидкости) на границе с насыщенным водным раствором. Если же в растворе находятся дифильные молекулы ПАВ, ассоциация углеводородных радикалов не приводит к образованию макрофазы, так как этому препятствует гидратация полярных групп молекул или электростатическое отталкивание их ионов. В растворе ПАВ уменьшение энтропии, вызванное усилением структур жидкой воды, компенсируется увеличением степени ассоциации ПАВ и обусловливает появление критической концентрации ми-целлообразования. [43]
В концентрированных растворах мыл и других коллоидных ПАВ ( концентрация выше ККМ) могут растворяться многие углеводороды, нерастворимые в воде. Растворение углеводородов происходит в результате проникновения их молекул внутрь мицелл мыла и взаимодействия с углеводородными цепями ПАВ. Такой процесс называют коллоидным растворением или солюбилизацией. Процесс протекает самопроизвольно и при этом образуются прозрачные, нерасслаивающиеся со временем равновесные растворы. [44]
Теплота смешения жидких азота и кислорода весьма мала, и она не учитывается. Теплоты растворения углеводородов при образовании керосина малы; они учтены в экспериментальном значении теплоты сгорания. [45]
Страницы: 1 2 3 4