Растворение - электролит
Cтраница 1
 |
Внесение ионов и молекулы электролита в растворитель. [1] |
Растворение электролита сопровождается образованием сольватированных ионов. [2]
Теплоты растворения электролитов в органических жидкостях более экзотермичны, чем в воде. Кроме того, экзотермичность ДЯряств с температурой в неводных растворах падает; в водных же растворах наблюдается обратное явление - нагревание приводит к белее отрицательным значениям ДЯраств. [3]
Теплоты растворения электролитов в органических жидкостях более экзотермичны, чем в воде. [4]
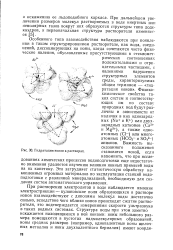
Процесс растворения электролита в воде схематически показан на рис. 1.10. Кристалл твердого электролита, например хлористого натрия, представляет собой пространственную решетку, в узлах которой, чередуясь, находятся ионы натрия и хлора. Каждый ион своими ближайшими соседями имеет противоположно заряженные ионы. Таким образом, весь кристалл является как бы громадной молекулой NanCln. Возникающие при этом силы оказываются способными вырвать ионы из кристаллической решетки. Переходя в раствор, ионы электролита окутываются оболочкой, состоящей из ориентированных молекул воды, и становятся гидратированными ионами. Участвуя в тепловом движении, такие ионы могут попадать в поле действия сил, исходящих от кристаллической решетки кристалла, если, разумеется, она не полностью разрушена. В этом случае ионы вновь занимают соответствующее место в решетке. [5]
При растворении электролитов, кристаллы которых построены из ионов, в раствор переходят не молекулы, а отдельные ионы; поэтому и равновесие в насыщенном растворе устанавливается между перешедшими в раствор ионами и твердой фазой растворенного вещества. [6]
При растворении электролита, например, CaSO4 в раствор переходят не молекулы, а ионы, следовательно, равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [7]
При растворении электролитов происходит разрушение кристаллической решетки растворяемого вещества, связанное с затратой энергии, и сольватация ионов. [8]
При растворении электролитов, например, солей, в раствор переходят ионы, а не молекулы. [9]
 |
Гидратация ионов в растворах. [10] |
При растворении электролитов в воде наблюдается явление электрострикции - кулоновские поля образующихся в растворе ионов взаимодействуют с диполями молекул воды достаточно сильно, вследствие чего вблизи ионов происходит сжатие растворителя, это подтверждается измерениями скорости ультразвука в таких водных системах. [11]
 |
Изотонические коэффициенты. [12] |
При растворении электролита его молекулы диссоциируют на ионы, причем по теории электролитической диссоциации степень диссоциации электролита зависит от разбавления. Если растворитель удаляется из раствора, концентрация электролита увеличивается, ионы при этом снова соединяются, образуя недиссоциированные молекулы. Наоборот, при разбавлении степень диссоциации возрастает. В растворе имеются катионы, анионы и недиссоциированные молекулы. При любой данной температуре между ними устанавливается определенное равновесие. [13]
При растворении электролитов в воде наблюдается явление электро-стрикции - кулоновские поля образующихся в растворе ионов взаимодействуют с диполями молекул воды достаточно сильно, вследствие чего вблизи ионов происходит сжатие растворителя, это подтверждается измерениями скорости ультразвука в таких водных системах. Структура воды при этом заметно искажается находящимися в ней ионами: ионы небольшого размера помещаются в пустотах надмолекулярных образований, ионы средних размеров ( например, одновалентные ионы щелочных металлов и ионы двухвалентного бериллия) имеют координационное число, равное четырем, и, очевидно, замещают молекулы воды в структурных узлах. Гидратированные ионы двухвалентных кальция и магния и трехвалентного алюминия могут быть представлены в виде октаэдров, в центре которых находятся ионы этих металлов, электростатически связанные с шестью молекулами воды, расположенными в их вершинах. Эти шесть молекул воды и составляют первую координационную сферу гидратированных многозарядных катионов. Отмеченное ион-дипольное взаимодействие наиболее характерно для гидратации катионов, при гидратации анионов со значительным зарядом или малым радиусом типично присоединение молекул воды за счет водородных связей. [14]
При растворении электролита в растворителе электролит диссоциирует на ионы и число частиц в растворе увеличивается по сравнению со случаем растворения неэлектролита. [15]
Страницы: 1 2 3 4