Растворение - электролит
Cтраница 3
При растворении электролитов, кристаллы которых построены из ионов, в раствор переходят не молекулы, а отдельные ионы; поэтому и равновесие в насыщенном растворе устанавливается между перешедшими в раствор ионами и твердой фазой растворенного вещества. При растворении осадка имеет место и обратный процесс - кристаллизация растворенного вещества. [31]
При растворении электролита в растворителе электролит диссоциирует на ионы, и число частиц в растворе больше, чем в случае растворения неэлектролита. [32]
При растворении электролитов происходит разрушение кристаллической решетки растворяемого вещества, связанное с затратой энергии, и сольватация ионов. [33]
При растворении электролита, па-пример соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [34]
При растворении поливалентных электролитов, а также ряда электролитов типа 1 - 1 вязкость воды возрастает, а при растворении нек-рых электролитов типа 1 - 1 ( напр. [35]
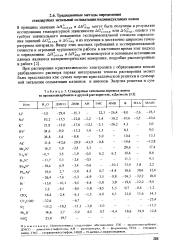 |
Стандартные энтальпии переноса ионов из пропиленкарбоната в другой растворитель, кДж / моль. [36] |
При растворении кристаллического электролита с образованием весьма разбавленного раствора первая интегральная теплота растворения может быть представлена как сумма энергии кристаллической решетки и суммарной энтальпии сольватации катионов и анионов. [37]
При растворении поливалентных электролитов, а также ряда электролитов типа 1 - I вязкость воды возрастает, а при растворении нек-рых электролитов типа 1 - 1 ( напр. [38]
Определяют энтальпию растворения электролита в смешанном водно-органическом растворителе при различном содержании органического компонента в смешанном растворителе. [39]
Интегральная теплота растворения электролитов является алгебраической суммой двух величин: 1) поглощения теплоты при разрушении кристаллической решетки ( АЯреш) и удаления ионов на расстояния в соответствии с объемом раствора и 2) выделения теплоты при гидратации или сольватации ДЯГИДр каждого иона молекулами растворителя. [40]
Суммарная теплота растворения электролитов включает энергию гидратации в более широком смысле и энергию [ решетки. Разрушение кристаллической решетки является эндотермическим процессом, тогда как гидратация в целом - экзотермический процесс. [41]
Ясно, что растворение электролита в воде должно способствовать диссоциации молекул электролита. Вода обладает большой диэлектрической проницаемостью ( е к 80); поэтому сила взаимодействия ионов в молекуле электролита. [42]
Равновесие кристаллизации и растворения электролита подчиняется всем правилам смещения равновесий. [43]
Второй способ применяется для растворения мало растворимых электролитов, которые являются производными слабых кислот или оснований. Так, растворение СаСОз, FeS или СазСРОф соляной кислотой обусловлено тем, что ЬЬСОз, HaS и НзРО4 - слабые кислоты. Образующийся слабый электролит может находиться в равновесии со своими ионами только при исключительно малых концентрациях последних. В каждом из, этих случаев большая концентрация НзО в растворе НС1 так понижает концентрацию аниона, что константа произведения растворимости не достигается, и поэтому мало растворимое соединение переходит в раствор. [44]
Литературные данные по теплотам растворения электролитов в воде и водных растворах при температурах, отличных от 25 С, весьма немногочисленны. [45]
Страницы: 1 2 3 4