Растворение - электролит
Cтраница 2
При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [16]
При растворении электролита в растворителе электролит диссоциирует на ионы и число частиц в растворе больше, чем в случае растворения неэлектролита. [17]
При растворении электролита его молекулы диссоциируют на ионы, причем по теории электролитической диссоциации степень диссоциации электролита зависит от разбавления. Если растворитель удаляется из раствора, концентрация электролита увеличивается, ионы при этом снова соединяются, образуя недиссоциированные молекулы. Обратно, при разбавлении степень диссоциации возрастает. В растворе присутствуют катионы, анионы и недиссоциированные молекулы. При определенной температуре между ними устанавливается определенное равновесие. [18]
При растворении электролита роль растворителя заключается в его разрушении, сольватации образующихся ионов и создании условий для разобщения ионов противоположного знака. Чем полярнее молекулы растворителя, тем легче протекает этот процесс. При растворении кова-лентных полярных соединений образование сольватированных ионов связано с гетеролитическим разрывом связей. [19]
При растворении электролитов в воде происходит либо выделение теплоты, либо ее поглощение; иначе говоря, процесс растворения является в основном химическим - процессом гидратации. Теплоту растворения обозначим буквой L. Поэтому на разрушение ее должна затрачиваться определенная энергия U. [20]
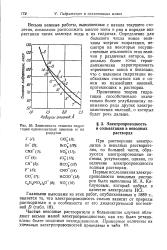 |
Зависимость теплоты гидратации одновалентных анионов от их радиусов. [21] |
При растворении электролитов в неводных растворителях, по большей части, образуются электропроводные системы, уступающие, однако, по величине электропроводности водным растворам. [22]
При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. Например, в насыщенном растворе сульфата кальция устанавливается. [23]
При растворении электролита, на-пример соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [24]
При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [25]
При растворении электролита, например соли, в раствор переходят не молекулы, а ноны; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [26]
При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. [27]
При растворении электролитов вокруг каждой молекулы или иона образуется оболочка из более или менее прочно связанных молекул растворителя. Это явление называется сольватацией. Движущей силой сольватации являются межмолекулярные взаимодействия между растворенным веществом и растворителем. Особенно сильно влияют на молекулы растворителя ионы электролита. В процессах сольватации имеет значение стехиометрия сольиатных комплексов ( число молекул растворителя на один ион), скорость обмена сольва-тированных молекул с нссольватированными, структуризация сольватпой оболочки. [28]
При растворении электролита в жидкости, например хлорида натрия в воде, взаимодействие молекул жидкости с молекулами электролита ослабляет связь между частями молекул электролита и некоторые из них разделяются на положительный и отрицательный ион. Разделение молекул электролита на ионы происходит за счет энергии теплового движения молекул. [29]
 |
Схема равновесия между осадком и ионами в растворе. [30] |
Страницы: 1 2 3 4