Активное растворение - титан
Cтраница 1
Активное растворение титана наблюдается в области потенциалов от - 0 37 В до - 0 26 В. [1]
 |
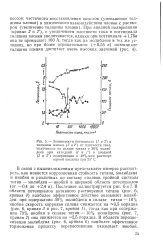
Зависимость тока ( 1 и валентно-сти ( 2 растворения титана от потенциала в деаэрированной 8 н. НС1, 21 С, п - 1000 об / мин. [2] |
НП активное растворение титана происходит с валентностью 3; на участке потенциалов пассивации ЕнпЕЕПп в раствор переходят как трех -, так и четырехвалентные ионы титана. В пассивной области в растворе обнаружены только 4 - х валентные ионы титана. [3]
 |
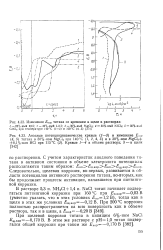
Изменение потенциала Ti во времени в кипящих 1 М растворах H2S04 в зависимости от концентрации ионов U6 и Fe3.| Поляризационные кривые Ti. [4] |
После участка активного растворения титана имеется область активно-пассивного состояния, а затем наступает анодная пассивность, обусловленная образованием на поверхности титана главным образом фазовых пленок. Скорость коррозии титана в широкой области потенциалов не зависит от потенциала. [5]
В области потенциалов активного растворения титана ( рис. 6, кривая 4) наиболее эффективное действие оказывает молибден: при содержании 30 % молибдена в сплаве титан-10 % ниобия скорость коррозии сплава снижается на - 3 5 порядка ( рис. 6, кривая 3 и рис. 7, кривая 1), тогда как при содержании 70 % ниобия в сплаве титан-10 % молибдена ( рис. 7, кривая 2) она снижается на - 2 5 порядка. В области перепассивации молибдена ( рис. 6, кривая 6) наиболее эффективное торможение процессу перепассивации оказывает ниобий. [7]
Следовательно, щелевая коррозия, во-первых, развивается в области потенциалов активного растворения титана, во-вторых, как бы продолжает процессы активации, начавшиеся при питтинго-вой коррозии. [9]
 |
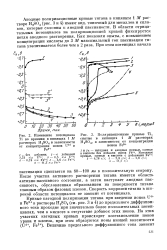
Анодные поляризационные кривые для титана в растворах H2S04 NaaS04 при 95 С. [10] |
Анализ диаграммы позволяет предсказать, что в растворах с рН 2 3 активное растворение титана не должно происходить. [11]
Повышенная температура была выбрана в связи с тем, что при 25 С скорость активного растворения титана в слабокислых растворах соизмерима с ошибками опыта. [12]
Стандартный электродный потенциал для реакции ионизации титана с образованием трехвалентных ионов ( что более характерно для активного растворения титана в большинстве условий) равен - 1 21 В. Это значение гораздо более отрицательно, чем потенциалы ионизации таких металлов как железо или цинк, что указывает на большую термодинамическую нестабильность титана по сравнению с этими металлами. Тем не менее, титан коррозионно более стоек, чем железо или цинк. Это зависит в первую очередь от большой склонности титана к пассивации. [13]
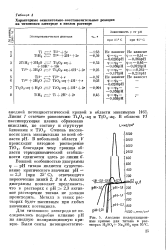
В щелочных, нейтральных и кислых окислительных средах, а также в разбавленных восстановительных кислотах участок активного растворения титана отсутствует. Исключение представляют растворы фторидов, где основными анодными процессами являются окисление металла и выделение кислорода. Образующаяся анодная окисная пленка постепенно прекращает процесс газовыделения, и при определенной величине возрастающей анодной поляризации становится возможным пробивание анодной пленки, что приводит к резкому увеличению скорости растворения при практически йостоянном потенциале. [14]
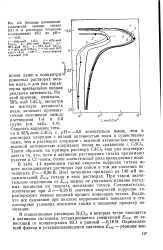 |
Анодные потенциоди-намические кривые титана ВТ1 - 0 в растворах хлоридов, , подкисленных НС1 до рН - 0 6. [15] |
Страницы: 1 2 3