Активное растворение - титан
Cтраница 2
Таким образом, на примере раствора CdCl2 еще раз подтверждается то, что, хотя в активном растворении титана принимают участие и С1 - - ионы, более значительная роль принадлежит воде. [16]
По представлениям сторонников этой теории, наиболее полно высказанных в работах Кея [ 406; 407J, в щели происходит активное растворение титана на участках локального подкисле-ния хлоридного раствора. Сопряженным катодным процессом становится восстановление Н - ИОНОБ, концентрация которых на участках локального подкисления остается постоянно высокой вследствие гидролиза продуктов коррозии и затрудненности отвода из щели Н - ИОНОБ и продуктов растворения. Так как со временем концентрация Н - ИОНОБ в щели возрастает, то скорость щелевой коррозии должна автокаталитически увеличиваться, и процесс активации в щели будет распространяться на новые поверхности. [17]
 |
Скорость коррозии титана и его сплавов в растворах хлоридов при 100 С. [18] |
С другой стороны, если продолжить сравнение поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. В соответствии с представлениями, развитыми школой Я. М. Колотыркина [332], при активном растворении металлов в процессе ионизации принимают участие как ОН - - ионы, так и другие анионы. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионы должны не только ускорять активное растворение титана, но и облегчать процессы активации. Действительно, сопоставление устойчивости титана к активации в растворах хлоридов и бромидов, как общей, так и локальной ( см. дальше), показывает, что титан значительно более устойчив в растворах бромидов. [19]
С другой стороны, если продолжить сравнеше поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионн должны не только ускорять активное растворение титана, но и облегчать процессы активации. Следует обратить внимание также на следующее обстоятельство. Значения могут характеризовать скорости растворения в пассивном состоянии. Поэтому в [ б ] такие соотношения п были связаны с растворением сплавов BTI-0 и 4200 только по данным анодных потенциодинамических кривых. С другой стороны, на потенциодинамических кривых может служить характеристикой не только скорости растворения, но и скорости образования оксидной пленки. В этой связи можно вспомнить работу [ гО ], в которой было установлено, что в 3 5 % растворе НаС1 в интервале значений рН 1 8 12 5 при 100 200 С легче всего образуется пассивная пленка ( анатаз) на сплаве т - 2 н; следующим по скорости роста пассивной пленки идет сплав к. [20]
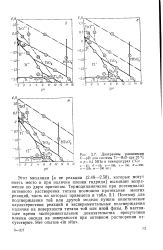 |
Диаграммы равновесия Е - рН для системы Ti-HzO при 25 С и р 0 1 МПа и температурах ( С. [21] |
Этот механизм [ а не реакции ( 2.48 - 2.50), которые могут иметь место и при наличии пленки гидрида ] вызывает возражение по двум причинам. Термодинамически при потенциалах активного растворения титана возможно протекание многих реакций, часть из которых приведена в табл. 2.1. Поэтому для подтверждения той или другой модели нужны кинетические характеристики реакций и экспериментальные подтверждения наличия на поверхности титана той или иной фазы. В настоящее время экспериментальные доказательства присутствия пленки оксида на поверхности при активном растворении отсутствуют. [22]
Видно, что стойкость титана существенно повышается при легировании 20 % Мо, незначительное улучшение наблюдается в сплавах с 50 % Zr и 50 % V. Большая часть легирующих элементов, особенно добавки алюминия, бериллия, хрома, железа, кобальта усиливает скорость активного растворения титана. [23]
На рис. 6 приведены типичные поляризационные кривые, снятые на титане потенциостатическим методом в 5 % - ном растворе серной кислоты при различных температурах. Из данных рисунка видно, что в анодной области имеется одна положительная ( по току) 1 петля, характеризующая активное растворение титана. С увеличением температуры значение критической плотности тока пассивирования резко повышается. Иначе говоря, с повышением температуры скорость коррозии титана возрастает и, для того чтобы его запассивировать, требуются более высокие значения анодной плотности тока. С увеличением концентрации кислоты повышается не только анодная критическая плотность тока на титановом электроде при его активном состоянии, но также увеличивается и анодная плотность тока при его пассивном состоянии; потенциал активации титана при этом смещается в направление более положительных значений. [24]
На рис. 5 представлены кривые, полученные при исследовании скорости коррозии при определенных заданных потенциалах. Кривые показывают, что максимальная скорость коррозии для титана ( кривая 1) имеет место при потенциале - 0 2 в, при этом потенциале наблюдаются области активного растворения титана. Сдвиг потенциала в положительную сторону способствует пассивированию титана и прекращению его коррозионного разрушения. Для исследованных сплавов титан-никель наблюдается следующее: по мере сдвига потенциала от - 0 3 в в положительную сторону скорость коррозии постепенно уменьшается, полностью прекращаясь при положительных потенциалах. Так, скорость коррозии сплава с 13 % никеля уже при потенциале 0 1 в практически равна нулю, тогда как для сплава с 50 % никеля минимальная скорость коррозии достигается только при потенциале 0 3 в. Это подтверждают также данные об изменении плотности тока во времени при различных потенциалах, соответствующих активному растворению Ti при - 0 2 в и активному растворению Ni при 0 1 в. При потенциале - 0 2 в у титана вначале наблюдается резкий рост анодной плотности тока, которая быстро достигает постоянного значения, тогда как у никеля и у сплава с 13 % никеля при этом потенциале анодная плотность тока не изменяется во времени и имеет отрицательное значение; при потенциале же 0 1 в ток имеет положительное значение. [25]
Коррозионная стойкость титана в растворах хлоридов значительно выше, чем нержавеющих сталей и сплавов на никелевой основе. Порог стойкости титана при переходе от одного раствора соли к другому заметно меняется. Например, активное растворение титана в растворах хлористого цинка начинается при концентрации соляной кислоты почти в 40 раз выше, чем в растворах хлористого лития. Труднее всего активное растворение титана наступает в чистой соляной кислоте, критическая концентрация которой в 50 раз выше, чем в растворах хлористого лития. Этот феномен объясняется главным образом различной активностью воды в исследуемых растворах. Как указывалось выше, вода является основным пассивирующим агентом для титана. [26]
Исследования, результаты которых приводятся ниже, касаются коррозионного и электрохимического поведения сплавов системы титан - молибден, а также нелегированных титана [32-34] и молибдена в растворах едкого кали при концентрациях от 40 до 50 % и температурах 100 - 150 С. На рис. 8 представлена зависимость скорости коррозии титана от потенциала, полученная в 50 % - ном растворе едкого кали. На потенциостатичееких кривых 1 и 2 имеются явно выраженные области активного растворения титана с максимумами при потенциале пассивации, равном - 0 7 в. Повышение концентрации щелочи увеличивает скорость коррозии титана. По сравнению с растворами кислот в щелочных растворах активная область растворения титана смещена к более отрицательным значениям потенциала. [27]
С другой стороны, если продолжить сравнеше поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионн должны не только ускорять активное растворение титана, но и облегчать процессы активации. Следует обратить внимание также на следующее обстоятельство. Значения могут характеризовать скорости растворения в пассивном состоянии. Поэтому в [ б ] такие соотношения п были связаны с растворением сплавов BTI-0 и 4200 только по данным анодных потенциодинамических кривых. С другой стороны, на потенциодинамических кривых может служить характеристикой не только скорости растворения, но и скорости образования оксидной пленки. В этой связи можно вспомнить работу [ гО ], в которой было установлено, что в 3 5 % растворе НаС1 в интервале значений рН 1 8 12 5 при 100 200 С легче всего образуется пассивная пленка ( анатаз) на сплаве т - 2 н; следующим по скорости роста пассивной пленки идет сплав к. [28]
Коррозионная стойкость титана в растворах хлоридов значительно выше, чем нержавеющих сталей и сплавов на никелевой основе. Порог стойкости титана при переходе от одного раствора соли к другому заметно меняется. Например, активное растворение титана в растворах хлористого цинка начинается при концентрации соляной кислоты почти в 40 раз выше, чем в растворах хлористого лития. Труднее всего активное растворение титана наступает в чистой соляной кислоте, критическая концентрация которой в 50 раз выше, чем в растворах хлористого лития. Этот феномен объясняется главным образом различной активностью воды в исследуемых растворах. Как указывалось выше, вода является основным пассивирующим агентом для титана. [29]
С другой стороны, если продолжить сравнение поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. В соответствии с представлениями, развитыми школой Я. М. Колотыркина [332], при активном растворении металлов в процессе ионизации принимают участие как ОН - - ионы, так и другие анионы. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионы должны не только ускорять активное растворение титана, но и облегчать процессы активации. Действительно, сопоставление устойчивости титана к активации в растворах хлоридов и бромидов, как общей, так и локальной ( см. дальше), показывает, что титан значительно более устойчив в растворах бромидов. [30]
Страницы: 1 2 3