Анодное растворение - железо
Cтраница 1
Анодное растворение железа в обычных электролитах ( сернокислый натрий, хлористый натрий), как уже указывалось, протекает без заметной поляризации. Однако достаточно ввести в электролит небольшое количество бихро-мата калия, чтобы растворение железа под током сопровождалось заметной поляризацией. Уже при очень малых плотностях тока скорость анодного процесса замедляется настолько, что потенциал анода достигает значений, достаточных для разряда ионов ОН - и выделения кислорода. [2]
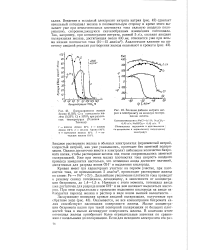
 |
Анодные поляризационные кривые железного электрода в кислых хлоридных растворах. [3] |
Анодное растворение железа в кислых хлоридных растворах имеет ряд характерных особенностей, что связано с участием в процессе анионов хлорида. Рассмотрим анодное растворение железа в присутствии БД и ТМБАП. То же самое наблюдается и в случае других ацетиленовых ингибиторов. [4]
Поскольку анодное растворение железа происходит почти со 100 % - ным полезным использованием тока при образовании соединений двухвалентного железа, 1 кг железа имеет токоотдачу около 960 Ач. Ввиду такой большой потери массы приходится применять большие количества железного лома П1 - Для защитной установки ( сила тока 10 А) из расчета на 20 лет эксплуатации требуется не менее 2 т железного лома. Железные анодные заземлители в грунте всегда укладывают с коксовой обсыпкой. Большая потеря материала заземлителя от коррозии компенсируется низкой его стоимостью и прочностью при транспортировке. [5]
Процесс анодного растворения железа во влажных грунтах начинается с перехода в почвенный электролит ион-атома металла, несущего положительный заряд. В дальнейшем происходит гидратирование иона-атома полярными молекулами воды и превращение его в нейтральную частицу. [6]
Процесс анодного растворения железа во влажных грунтах начинается с перехода в грунтовый электролит иона-атома металла, несущего положительный заряд. В дальнейшем ион-атом гидратируется полярными молекулами воды и превращается в нейтральную частицу. При недостатке полярных молекул воды происходит накапливание положительных ионов-атомов в приэлектродном слое, т.е. сдвиг потенциала анода в положительную сторону ( анодная поляризация), уменьшающий скорость анодного растворения. Таким образом, при уменьшении влажности грунта скорость коррозии снижается. Для абсолютно сухих грунтов скорость электрохимической коррозии равна нулю. [7]
Процесс анодного растворения железа во влажных грунтах начинается с перехода в почвенный электролит ион-атома металла, несущего положительный заряд. В дальнейшем происходит гидратирование иона-атома полярными молекулами воды и превращение его в нейтральную частицу. [8]
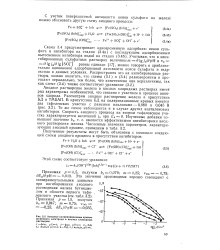
 |
Изменение потенциала и распределения иоиов вблизи поверхности электрода. [9] |
Многочисленные исследования анодного растворения железа и других металлов этой группы ( Со, Ni) показали [9, 21-26], что скорость растворения их в кислых средах зависит от рН и с возрастанием рН увеличивается. [10]
Рассмотрим процесс анодного растворения железа в минеральной кислоте. Спрашивается, какие ионы железа будут в этом случае отщепляться в раствор. [11]
 |
Характеристики анодных аммония и иодида поверх. [12] |
Конечный продукт анодного растворения железа - ионы Fe 2 - появляется в ходе стадии ( 3.1 в), которая определяет скорость всего процесса. [13]
Потенциостатические исследования кинетики анодного растворения железа ( рис. 5 23) показали, что анион бензойной кислоты оказывает сильное влияние на скорость анодного растворения железа. Такое пассивирующее влияние бензоата натрия в присутствии кислорода объясняется тем, что анион бензойной кислоты С6Н5СОО - образует с железом через карбоксильные группы прочную химическую связь. Это уменьшает реакционную способность значительной части атомов железа на поверхности и облегчает пассивацию остальной части кислородом воды. На катодную реакцию, как и ожидалось, бензоат влияния не оказывает. [14]
Поскольку обычно процесс анодного растворения железа протекает интенсивнее процесса его окисления при разряде ионов ОН -, воду приходится дополнительно аэрировать либо хлорировать, для того чтобы обеспечить полное осаждение гидроокиси трехвалентного железа в осветлителе. [15]
Страницы: 1 2 3 4