Анодное растворение - железо
Cтраница 4
Подобно тому, как было объяснено влияние галогенид-ионов на кинетику и механизм анодного растворения железа, можно объяснить влияние хлорид - и сульфат-ионов на анодное поведение никеля. [46]
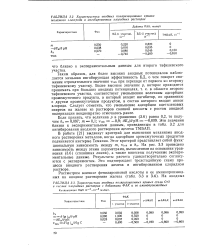
Суть этого наблюдения заключается в том, что обратный процесс, а именно анодное растворение железа, кобальта и йикеля, сопровождается значительной поляризацией, которая быстро уменьшается по мере повышения температуры. Вероятно, как при разряде, так и при образовании ионов должен быть преодолен высокий энергетический барьер; приблизительные расчеты, проделанные на основе данных табл. 81, указывают на то, что высота этого барьера для прямого процесса составляет 12 - 18 ккал. [47]
Эти значения близки к экспериментальным данным, приведенным в табл. 3.2 для ингйбирования анодного растворения железа ТМБАП. [49]
Применяются также железосодержащие коагулянты, полученные хлорированием железной стружки в водной среде и анодным растворением железа в растворах хлорида натрия или серной кислоты. Соли железа предпочтительно применять при очистке мутных жестких вод с высоким значением рН [91], а также при очистке стоков. Они позволяют устранять запахи и привкусы, обусловленные присутствием сероводорода, удалять соединения мышьяка, марганца, меди, а также способствуют окислению органических соединений. [50]
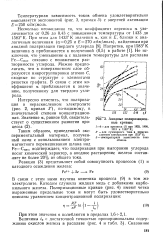 |
Анодные поляризационные кривые. [51] |
Снас, подтверждает, что поляризация при выгорании углерода носит химический характер, а анодное растворение железа составляет не более 20 % от общего тока. [52]
Несмотря на разнообразие экспериментальных данных, большинство исследователей все же подчеркивает участие ОН в анодном растворении железа. [53]
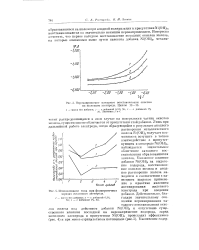 |
Использование тока при формировочных нарядах железного электрода. [54] |
Указанное влияние добавки Ni ( OH) 2 на выделение водорода, восстановление окислов железа и анодное растворение железа находится в соответствии с нашедшим широкое применение в практике явлением активирования железного электрода при введении добавки. [55]
Рекомендуемое напряжение на ячейках при расстоянии между электродами, равном 10 - 12 мм, для анодного растворения железа составляет 3 В, а для растворения алюминия 4 В. Из опыта освоения электрокоагуляторов рекомендуется поддерживать плотность тока около 10 А / м2, а скорость потока воды между пластинами - не менее 0 5 м / с. Расход электроэнергии на электрокоагуляцию составляет 0 05 - 0 5 кВт - ч / т воды. [56]
Железобактерии поглощают железо в ионном состоянии и выделяют в виде нерастворимых соединений, благодаря чему ускоряется процесс анодного растворения железа. На отдельных участках поверхности металла могут осаждаться продукты разложения микроорганизмов в виде пленок, обладающих более высоким потенциалом, чем железо. Одновременно с этим ранее образованные пассивные защитные пленки могут разрушаться бактериями. [57]
Все это показывает что даже в сравнительно простых электролитах ( 0 1 N раствор H2SO4) процесс анодного растворения железа необратим. [58]
Страницы: 1 2 3 4