Анодное растворение - никель
Cтраница 2
Особенность анодного растворения никеля заключается в склонности никеля к пассивированию, особенно в нейтральных и слабокислых растворах. Поэтому и на аноде требуется значительная поляризация для растворения никеля, что приводит к растворению на аноде примесей более электроположительных металлов - сурьмы, мышьяка, меди. Повышение температуры препятствует, а повышение плотности тока способствует пассивированию. Растворение облегчается в присутствии ионов СГ в электролите. [16]
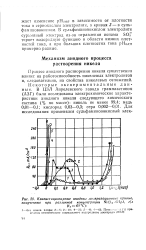 |
Квазистационарные анодные поляризационные кривые, полученные при различной концентрации № СЬ 6Н2О, г / л. [17] |
Процесс анодного растворения никеля существенно влияет на работоспособность никелевых электролитов и, следовательно, на свойства никелевых отложений. [18]
Так как анодное растворение никеля сопровождается большой поляризацией, то уже при малой плотности тока ( рис. 105, участок АБ) наблюдается электрохимическое образование закиси никеля NiO. Адатомы никеля, участвующие в образовании окисной пленки, не теряя связи с кристаллической решеткой металла, обусловливают тем самым прочное сцепление фазовой пленки с металлом и со - гt Б здают надежную изоляцию его от электролита. Из-за трудности встречной диффузии ионов металла и кислорода в пленке происходит дальнейшее самоторможение образования пленки, толщина ее достигает лишь нескольких молекулярных слоев. Образовавшаяся окисная пленка обладает некоторой устойчивостью и после устране - ( ния причин, вызвавших ее появление. Это отчетливо наблюдается при снятии поляризационной кривой в обратном направлении. [19]
Изучен процесс анодного растворения никеля переменным синусоидальным током различных амплитуд и частот. [20]
Наиболее целесообразным методом анодного растворения никеля является бездиафрагменный метод с проточным электролитом, позволяющий получать концентрированные растворы хлорида никеля, пригодные для изготовления продукта реактивной квалификации. [21]
Таким образом, проводить процесс анодного растворения никеля без диафрагмы нецелесообразно. [22]
 |
Зависимость скорости анодного процесса на никеле в кислых сульфатных растворах от рН при [ SO - 11 моль / л и концентрации [ С1 - ], моль / л. [23] |
Рассмотрим влияние хлорид-ионов на кинетику анодного растворения никеля в кислых сульфатных растворах. [24]
Применим тот же подход для объяснения механизма анодного растворения никеля в кислых сульфатных растворах. [25]
 |
Кинетические характеристики анодного растворения никеля в кислых сульфатных растворах с добавками сульфата и хлорида калия. [26] |
На рис. 3.7 показана зависимость плотности тока анодного растворения никеля от рН сульфатного раствора при различных концентрациях сульфат-ионов. В соответствии с литературными данными [17,20] видно, что до рН 2 / а практически от рН не зависит, но увеличивается с ростом концентрации сульфат-ионов. [27]
Эта же аномалия служит причиной того, что анодное растворение никеля происходит значительно медленнее, чем можно было бы ожидать. Это несомненно является также причиной того, что никель, который, как это следует из положения его в ряду напряжений, должен был бы легко выделять водород из кислот, в действительности выделяет его очень медленно, даже находясь в контакте с платиновой чернью. [28]
 |
Зависимость скорости коррозии никеля. [29] |
С целью определения воздействия биологической среды на скорость анодного растворения никеля в диапазоне потенциалов, соответствующих активной области ( 0 0 0 6 В), были измерены его истинные анодные характеристики в исследуемых средах. [30]
Страницы: 1 2 3 4