Анодное растворение - никель
Cтраница 3
При употреблении никелевого электрода в кислой среде становится заметным анодное растворение никеля. [31]
 |
Опытные данные при электроосажденип двуокиси свинца. [32] |
Таким путем удается с самого начала электролиза подавить процесс анодного растворения никеля в нитратном электролите; осадок получается менее пористым. [33]
На рис. 2 представлены зависимости выхода по току при анодном растворении никеля от частоты и величины общего тока. Область выше кривой обусловлена влиянием емкостного тока. С ростом частоты, как видно из рис. 2, доля емкостного тока линейно возрастает. С увеличением общего тока доля емкостного тока в общем балансе электродного процесса снижается за счет увеличения тока реакции. [34]
Таким образом, предположение о том, что адсорбция промежуточных продуктов анодного растворения никеля подчиняется изотерме Тем-кина, позволило с единых позиций, используя 3-стадийные схемы, объяснить особенности анодного поведения этого металла. [35]
В табл. 1 приведены результаты опытов, из которых следует, что только 65 - 83 % тока используется на анодное растворение никеля. [36]
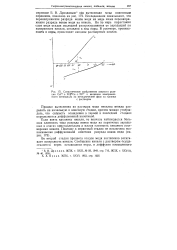 |
Схематическое изображение скорости реакции Cu2 Ni Cu Ni2 и величины компромиссного потенциала на металлической фазе на границе с раствором. [37] |
Если взять крупинку никеля, то вначале наблюдается большая плотность тока разряда ионов меди на первичных зародышах и очагах кристаллизации и малая плотность анодного растворения никеля. [38]
Общим для этих теорий является предположение о непосредственном участии гидроксокомплек-сов железа ( ионов ОН -) в медленной электрохимической стадии. Скорость анодного растворения никеля [49 - 51] и кобальта [52 - 54] также возрастает с увеличением рН раствора, что говорит о сходном поведении анодов из металлов группы железа в кислых некомплексных электролитах. [39]
В качестве катода применяется железо, медь или сталь, а в качестве анода - никель. Вследствие анодного растворения никеля концентрация его в ванне поддерживается более или менее постоянной. Концентрация вольфрама поддерживается при длительной работе ванны за счет вольфрамовой кислоты, помещаемой в сухом виде на дно ванны и постепенно растворяющейся в аммиаке, который, как указано, добавляется в ванну в довольно большом количестве. [40]
При высоких плотностях тока ( потенциалах) в присутствии кислородсодержащих анионов ( например, СЮ4 -) и воды наступает пассивация электрода. В ДМСО скорость анодного растворения никеля на несколько порядков ниже, чем в других растворителях, в том числе и воде. [41]
 |
Влияние толщины пленки электролита на анодную поляризацию магния в О. N растворе NaCl.| Возможные анодные реакции для магния и значения их потенциалов. [42] |
Анодное поведение никеля в тонких слоях электролита напоминает поведение алюминия и магния в аналогичных условиях. Впрочем, аномальные явления при анодном растворении никеля не обнаруживаются. [43]
Таким образом, используя различные окислители, находящиеся в растворе, металлу можно задать потенциал как в активной, так и в пассивной области. Это проиллюстрировано на рис. 1.10 для реакции анодного растворения никеля в серной кислоте. Из рисунка видно, что скорость реакции растворения никеля при заданном потенциале от внешнего источника напряжения практически совпадает со скоростью его растворения, определенной по анализу раствора, в растворе окислителя, навязывающего никелю тот же потенциал. [44]
Проведены коррозионные и электрохимические измерения на никеле в культурах почвенных бактерий рода Thiobaciiiue и соответствующих им модельных средах. Установлено, что в биологически активных средах процесс анодного растворения никеля протекает значительно интенсивнее, чем в модельных растворах. [45]
Страницы: 1 2 3 4