Анодное растворение - сталь
Cтраница 2
Различие в поведении углеродистой стали в разбавленной и концентрированной серной кислоте дает основание предположить разную природу пассивного состояния в этих случаях. Анодное растворение стали определяется диффузионным отводом продуктов коррозии. Плотность предельного диффузионного тока эквивалентна скорости коррозии. Пассивность стали в 60 % - ной H2S04 обусловлена образованием на поверхности оптически однородной пленки, состоящей, по-видимому, из безводного сульфата железа. [16]
Существует мнение ряда исследователей [30,101] о возможности смены механизмов разрушения в процессе роста трещин КРН. Может наблюдаться сочетание локального анодного растворения стали в вершине трещины при ее зарождении и в начальный период, с хрупким механическим ( водородным) разрушением на развитой стадии процесса. [17]
Известно, что наклон поляризационных кривых ( их крутизна) характеризует степень затруднения соответствующей ( анодной или катодной) электрохимической реакции. Исследования показали, что анодное растворение стали происходит беспрепятственно, в то время как катодная реакция на поверхности стали затруднена, особенно при поляризации. На медной фольге крутизна катодной кривой в 20 раз больше, чем анодной, а на медном покрытии по сравнению с медной фольгой возрастает крутизна как анодной, так и катодной кривых, однако соотношение между ними остается без изменений. Это подтверждает сделанный ранее вывод об усилении пассивности медных и латунных покрытий в первой стадии испытаний. По-видимому, в начальной стадии значительное влияние на ход кривой оказывает цинк, содержащийся в латуни. Корреляции между крутизной анодных кривых и скоростью коррозионного разрушения не обнаружено. Вероятно, стадией, контролирующей процесс электрохимической коррозии, является катодная реакция. [18]
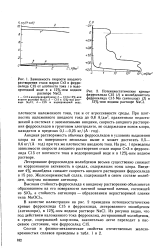 |
Зависимость скорости анодного растворения стали марки СтЗ и ферро-силида С15 от плотности тока i в водопроводной воде и в 12 % - ном водном растворе NaCl.| Потенциостатические кривые. [19] |
Анодная растворимость обычных ферросилидов в условиях выделения хлора на их поверхности несколько выше и может достигать 0 5 - 0 6 кг / ( А год) при тех же плотностях анодного тока. На рис. 1 приведены зависимости скорости анодного растворения стали марки СтЗ и ферросилида С15 от плотности тока в водопроводной воде и в 12 % - ном водном растворе. [20]
Таким образом, данные этой работы не подтверждают взгляды Дж. Трезедера [411], согласно которым первоначальные трещины зарождаются в результате анодного растворения стали, а развитие трещин происходит под действием напряжений, связанных с насыщением металла у вершины трещины водородом. [21]
Из табл. 3.3 и 3.4 видно, что эффективность ФАК и ее производных при торможении анодного растворения стали возрастает в ряду: ФАК, о - АФАК, лг - АФАК, п - АФАК. В таком же ряду возрастает ингибирующее действие добавок при торможении катодного выделения водорода, что, как было отмечено выше, связано с усилением адсорбции этих ПАВ в том же порядке. При ингибировании анодного процесса на железе различия между изомерами АФАК практически не наблюдается. [23]
Для определения количества углерода, содержащегося в а - или у-железе, измеряют адсорбцию водного раствора бромтимол-си-него на карбидных осадках. Этот краситель не поглощается карбидами и графитом, но поглощается аморфным углеродом, выпавшим из твердого раствора при анодном растворении стали. Поэтому количество адсорбированного красителя пропорционально количеству углерода в твердом растворе стали. [24]
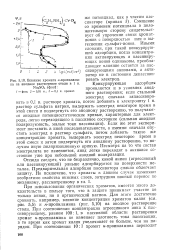 |
Влияние хромата - пропилами - ровать электрод. [25] |
При использовании органических хроматов, имеется много доказательств в пользу того, что в защите принимает участие не только анион, но и органический катион. Для этого достаточно сравнить, например, влияние концентрации хроматов калия ( см. рис. 5 5) и н-пропиламина ( рис. 5 10) на анодное растворение стали. При соотношении концентрации агрессивного иона к пассивирующему, равном 100: 1, в пассивной области растворения хромат н-пропиламина не изменяет плотность тока пассивации, в то время как хромат калия увеличивает ее больше, чем на порядок. [26]
По результатам испытаний можно заключить, что водные среды в процессе катодной поляризации способствуют интенсивному наводораживанию поверхностного слоя и его охрупчива-нию, в результате чего прочность образцов стали марки 20ХНЗА в сечении концентратора напряжений снижается более чем в 3 раза по сравнению с испытаниями в воздухе. Добавки к водным средам ПАВ типа ОП-10, сульфонола, СМАД-1, СГ, ЭПСГ ингибируют наводораживание, однако степень ингибирования наводораживания существенно ниже степени ингибн-рования анодного растворения стали. [27]
Наряду с положительными свойствами гальванические покрытия имеют недостатки: наводороживание основы при нанесении покрытия; наличие водорода в изделии вызывает водородную хрупкость, снижающую как длительную, так и циклическую прочность. Влияние гальванопокрытий хромом, никелем, медью на выносливость стали в воздухе в значительной степени связано с появлением в приповерхностном слое остаточных напряжений растяжения, которые при воздействии коррозионной среды вследствие нарушения сплошности этих покрытий, являющихся катодными по отношению к стали, усиливают анодное растворение стали. Остаточные напряжения растяжения - не единственный фактор, вызывающий снижение усталостной прочности стали. [28]
Причины этого выяснены не во всех случаях, но многое уже известно. Так, при электрополировке меди и латуни в ортофосфорной кислоте предельная плотность тока обусловлена диффузионным ограничением процесса. При анодном растворении сталей первый горизонтальный участок на поляризационной кривой обусловлен пассивацией металла. Электрополировка осуществляется при более высоких плотностях тока, когда наступает второй скачок потенциала, возможно, также связанный с диффузионными ограничениями. [29]
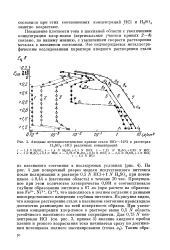 |
Анодные потенциостатические кривые стали 18Сг - 14N1 в растворах H2S04 HC1 различных концентраций. [30] |
Страницы: 1 2 3