Электрохимическое растворение
Cтраница 2
При электрохимическом растворении осадков на твердых электродах во многих случаях наблюдаются два или даже три пика ионизации осажденного вещества. Одновременно с главным, или основным, пиком регистрируются пики при более положительных потенциалах. Их появление обусловлено различным энергетическим состоянием атомов металла в осадке, поскольку первый монослой осадка связан с поверхностью электрода сильнее, чем последующие слои между собой. Кроме того, энергия связи первого монослоя с электродом не одинакова и зависит от состояния его поверхности. [16]
При электрохимическом растворении золотых анодов такие примеси, как платиновые металлы и примеси лигатуры, практически пол-ностью переходят в электролит и накапливаются в нем. Отработанный электролит по мере обогащения примесями для предотвращения их возможного перехода в катодный осадок периодически заменяют. При очистке электролита из него сначала электролизом в отдельных ваннах с графитовыми анодами выделяют большую часть золота, а затем разными методами извлекают остатки золота и платиноиды. [17]
Строкачу, электрохимическое растворение метал лов состоит из двух основных процессов - анодного и хими ческого растворения в результате взаимодействия с окружаю щей средой. Растворению металла анода способствуют повы шение температуры воды, присутствие в ней ионов-депассива торов, наложение постоянного электрического тока, повышенш скорости движения воды по отношению к поверхности метал ла. Поэтому выход алюминия по току может достигать 120 % i более. В соответствии с теорией электрохимической коррозш при использовании в качестве анода железа или алюминия i природной воде протекают реакции анодного растворения i образования гидроксидов этих металлов. На катоде из желез; или алюминия в природной воде происходят деполяризацю мигрирующими ионами, деполяризация нейтральными молеку лами, восстановление ионов металлов и нерастворимых пле нок, а также органических соединений. Из вышеуказанных катодны: процессов в природной воде главенствующим является водо родная и кислородная деполяризация. [18]
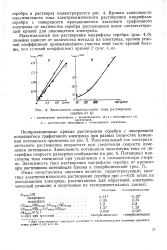 |
Зависимость максимального тока растворения серебра от Q. [19] |
Максимальный ток электрохимического растворения возрастает при увеличении скорости изменения потенциала. Потенциал максимума тока смещается при увеличении v в положительную сторону. [20]
В условиях электрохимического растворения наблюдали повышение температуры электролита на At 33 - 53, что обусловлено активирующим воздействием переменного тока на процесс растворения свинца в азотной кислоте. Можно предположить, что активирующее действие переменного тока заключается в снятии окисных пленок в катодный полупериод переменного тока за счет изменения поляризации электрода. [21]
Скорость процесса электрохимического растворения определяется скоростью самой медленной стадии и измеряется числом ионов, переходящих в раствор с единицы поверхности в единицу времени. [22]
Возможности интенсификации электрохимического растворения, связанные с изменением состава и концентрации электролита, определяются влиянием этих факторов на кинетику электродных процессов. По мере разбавления электролита увеличивается градиент концентрации продуктов растворения и должна бы возрастать скорость растворения. Однако удельная электропроводность электролита уменьшается и потери энергии на нагревание увеличиваются. [23]
Изучены процессы электрохимического растворения серебра с поверхности графитового62 и платинового57 - 62 электродов. Эксперимент осуществляли в две стадии: осаждение серебра на вращающемся электроде при потенциале, соответствующем предельному току диффузии ионов металла ( продолжительность осаждения составляла 60 сек, потенциал - 0 6 в относительно меркурсульфатно-го электрода); электрохимическое растворение при линейном изменении потенциала вращающегося или неподвижного электрода. После первой стадии электроду сообщали потенциал, близкий к равновесному. В качестве рабочего электрода использовали дисковые диаметром 2 мм, графитовый ( тип I) и платиновый электроды. [24]
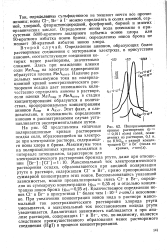 |
Поляризационные кривые растворения ( и 0 011 в / сек солей, осажденных из растворов, 0 1 н. по RNO3, с разной концентрацией СР и Вг - ( числа на кривых, г-ион / л. [25] |
Максимальный ток электрохимического растворения осадка, образовавшегося при анодной поляризации ртути в растворе, содержащем СГ - и Вг -, прямо пропорционален суммарной концентрации этих ионов. Количественное определение ионов Сг и Вг - в присутствии I - более чем 1 10 - 5 г-ион / л невозможно. При увеличении концентрации ионов иода в растворе максимальный ток электрохимического растворения хлорида ртути уменьшается, а максимальный ток восстановления иодида ртути увеличивается. Аналогичная зависимость наблюдается и при анализе растворов, содержащих 1 - и Вг -, что, по-видимому, является следствием преимущественного образования менее растворимого соединения ( Hgl) в процессе концентрирования. [26]
Скорость процесса электрохимического растворения родия составляет 4 57 10 - 2 г / час в начале процесса н резко снижается с ростом концентрации соли сернокислого родия в растворе. [27]
Наряду с электрохимическим растворением, при определенных значениях рН раствора, а также концентрации растворенных углекислого газа и кислорода, может происходить и химическое растворение анода. Оказалось, что при обычно применяемых в кулонометрии условиях ( продолжительность генерирования не более 20 мин; площадь генераторного анода 8 см2; анолит - 0 2 М раствор KNO3 в дистиллированной воде, насыщенной воздухом) количество химически растворенного свинца незначительно и составляет не более 0 2 % от количества РЬ2, полученного в результате электрохимического процесса. Определение миллиграммовых количеств перечисленных ионов ( - 1 3 - 13 мг или несколько выше) осуществляют в растворах KNO3, концентрация которого колеблется от 0 2 до 0 5 моль в зависимости от определяемого аниона. При определении Fe ( CN) 6 - и некоторых других ионов значение рН ано-лита поддерживают в пределах, исключающих как химическое растворение свинца, так и образование посторонних осадков. [28]
Электролит готовится электрохимическим растворением свинца и олова с применением пористой диафрагмы. [29]
При травлении происходит электрохимическое растворение железа на границе раздела металл - пленка оксида, куда электролит проникает через поры и трещины в слое окалины и ржавчины. Слой загрязнения в гальванической паре Fe-Ре От - д: Н2О служит катодом, а металл подложки - анодом. [30]
Страницы: 1 2 3 4