Растворимость - кислота
Cтраница 2
 |
Зависимость логарифма коэффициента активности серебряных солей органических кислот от диэлектрической проницаемости спиртов ( в качестве стандартно и среды выбран метиловый спирч. [16] |
С изменением растворителя - по-разному изменяется растворимость кислот, образующих соли. [17]
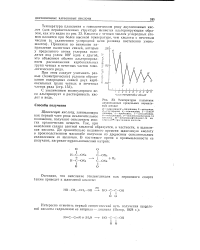 |
Температуры плавления двухосновных предельных нормальных кислот. [18] |
С увеличением молекулярного веса альтернирует и растворимость кислот в воде. [19]
Так, в работе [122] изучена растворимость фосфорномолибде-новой кислоты ( ФМК) в воде и бутаноле, а также распределение ФМК между этими жидкостями. Авторы установили, что изменения величины коэффициента распределения D обусловлены состоянием ФМК в водной фазе. В концентрированных растворах ФМК ноходится в виде полимеров, которые бутанолом не экстрагируются; при разбавлении ( до 0 003 М) увеличивается доля мономерных форм, при дальнейшем разбавлении доминируют ионы ФМК, что приводит к уменьшению D. Прибавление азотной кислоты сдвигает равновесие в сторону образования мономерных молекул, что приводит к увеличению D. Избыток молибдата натрия уменьшает степень экстракции. [20]
Пределы изменения рН водных растворов определяются растворимостью кислот и щелочей в воде и коэффициентами активности в концентрированных растворах кислот и щелочей. [21]
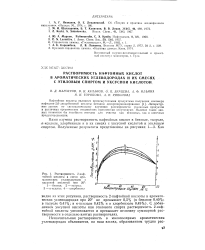 |
Растворимость 2-наф-тойной кислоты в смеси ароматических углеводородов с уксусной кислотой при 20. [22] |
С добавлением уксусной кислоты или этилового спирта растворимость 2-нафтойной кислоты увеличивается и превышает величину суммарной растворимости в отдельно взятых растворителях. [23]
С увеличением числа гидрофильных групп-карбоксильных, гидроксиль-ных-в молекуле кислоты растворимость кислот в воде-обычно возрастает; наоборот, с увеличением числа атомов углерода в молекуле кислоты растворимость кислот снижается. [24]
Из приведенных данных видно, что при более высокой температуре растворимость кислот в том числе и сульфокислот, больше. [25]
Прежде чем приступать к определению эквивалентного веса кислоты, необходимо установить растворимость кислоты в воде. Если кислота в воде растворима, проводят прямое титрование раствором едкого натра. Для определения эквивалентного веса кислоты, не растворимой в воде, навеску растворяют в избытке щелочи и оттитровывают избыток щелочи кислотой или же кислоту растворяют в этиловом спирте и титруют едким натром в присутствии фенолфталеина. [26]
Прежде чем приступить к определению эквивалентного веса кислоты, необходимо установить растворимость кислоты в воде. Если кислота в воде растворима, проводят прямое титрование раствором едкого натра. Для определения эквивалентного веса кислоты, не растворимой в воде, навеску растворяют в избытке щелочи и оттитровывают избыток щелочи кислотой или же кислоту растворяют в этиловом спирте и титруют едким натром в присутствии фенолфталеина. [27]
С увеличением числа гидрофильных групп-карбоксильных, гидроксильных - в молекуле кислоты растворимость кислот в воде обычно возрастает, а с увели-чени. [28]
Прежде чем приступать к определению эквивалентного веса кислоты, необходимо установить растворимость кислоты в воде. Если кислота в воде растворима, проводят прямое титрование раствором едкого натра. Для определения эквивалентного веса кислоты, не растворимой в воде, навеску растворяют в избытке щелочи и оттитровывают избыток щелочи кислотой или же кислоту растворяют в этиловом спирте и титруют едким натром в присутствии фенолфталеина. [29]
Щавелевая кислота - бесцветное кристаллическое вещество, частично растворяющееся в воде ( растворимость кислоты в воде при 20 С составляет 9 5 %), токсична. [30]
Страницы: 1 2 3 4