Растворимость - кислота
Cтраница 3
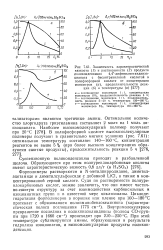
Синергическое действие добавок уксусной кислоты и этилового спирта, способных образовывать водородные связи, на растворимость яафтойных кислот в ароматических углеводородах связанр, очевидно, с тем, что они разрушают димеры кислот. Об этом свидетельствуют данные работы [5], в которой показано, что бензойная кислота при концентрации 0 5 мол / кг в бензоле димеризована практически полностью, а в уксусной кислоте и этиловом спирте находится в мономерной форме. [31]
Если ЛГн2о 7 - 10 - 14, то концентрация КОН, равная 10 - 4, увеличит растворимость кислоты в 103 раз. В области III растворимость кислоты не увеличивается, поскольку увеличение растворимости определяется исключительно условием нейтральности и имеет место только тогда, когда в уравнении нейтральности учитываются концентрации ионов основания. Особый интерес представляет положение, возникающее в области II, где [ К 1 [ Ас - ] const несмотря на то, что рдсн ( и, таким образом, активность кислоты) значительно изменяется. Концентрации, а следовательно, и активности других частиц в этой области также заметно изменяются. [32]
Замечено, что если осадить вначале наиболее гидрофильные оксикарбоновые кислоты, а затем ввести дополнительное количество неполярного растворителя с целью понижения растворимости более гидрофобных кислот, то, вопреки ожиданиям, добиться почти полного осаждения не удается. Объясняется это тем, что наличие гидрофильных оксикарбоновых кислот облегчает образование частиц менее гидрофильных оксикарбоновых кислот и их выпадение из сложного раствора. [33]
Температура, необходимая для достижения высокой скорости окисления, обычно находится в пределах 120 - 200 С, причем ее выбор иногда обусловлен растворимостью кислоты в реакционной массе. [34]
Температура, необходимая для достижения высокой скорости окисления, обычно находится в пределах 120 - 200 G, причем ее выбор иногда обусловлен условиями растворимости кислоты в реакционной массе. [35]
Температура, необходимая для достижения высокой скорости окисления, обычно находится в пределах 120 - 200 С, причем ее выбор иногда обусловлен условиями растворимости кислоты в реакционной массе. [36]
С увеличением числа гидрофильных групп-карбоксильных, гидроксиль-ных-в молекуле кислоты растворимость кислот в воде-обычно возрастает; наоборот, с увеличением числа атомов углерода в молекуле кислоты растворимость кислот снижается. [37]
Валериановая кислота для полного растворения должна требовать не меньше, чем 26 частей воды; примесь низших гомологических кислот, а также спирта, повышает растворимость кислоты. [38]
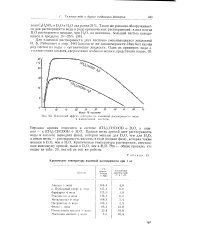 |
Изотопный эффект дейтерия во взаимной растворимости воды и изомасляной кислоты. [39] |
Верхняя кривая относится к системе ( CH3) CHCOOD D O, а нижняя - к ( CH3) iCHCOOH H. O. Правая ветвь кривой дает растворимость воды в кислоте ( неводная фаза), которая меньше для DO, чем для Н2О, а левая ветвь - растворимость кислоты в воде ( водная фаза), которая также меньше в D. [40]
Определение слабых индивидуальных одноосновных ( монопротонных) кислот, таких как НСООН КА 1 8 - I0 - 4) СНэСООН ( / 1 74 - 1Г5), С6Н5СООН ( КАе2 - Ю-6), С6Н4 ( НО) СООН ( КА 1 № - 3), также не представляет особых затруднений в тех случаях, когда растворимость кислоты в воде позволяет приготовить ее 0 1 - 0 01 М раствор. Такие кислоты обычно определяют титрованием стандартным раствором щелочи в присутствии индикатора фенолфталеина. Однако в каждом конкретном случае необходимо рассчитать рН начала н конца скачка титрования, а также рН в ТЭ, учитывая растворимость кислоты в воде при комнатной температуре, н подобрать соответствующий индикатор. [41]
Ароматические углеводороды нефтяных дистиллятов образуют сульфоновыс кислоты, растворимые в воде. Растворимость суль-фоноьых кислот в нефтяных дистиллятах зависит от молекулярного Зеса и строения кислот. [42]
Так как растворимость кислот мала, даже их пересыщенные растворы весьма разбавлены ( - 1), так что электропроводность является линейной функцией концентрации и, следовательно, мерой степени превращения. [43]
Форполимеры растворяются в N-метилпирролидоне, диметил-ацетамиде и диметилсульфоксиде с добавкой LiCl, а также в концентрированной серной кислоте. Судя по растворимости полиуре-идокарбоновых кислот, можно заключить, что они имеют частич-но-сшитую структуру за счет взаимодействия карбоксильных и изоцианатных групп и в известной мере циклизованы. Внутримолекулярное превращение последних в полихиназолиндиокы ( полосы СО-группы при 1720 и 1660 см -) происходит при 230 - 250 С. При этой температуре сублимируются амины, образующиеся в результате гидролиза изоцианатов, и низкомолекулярные продукты поликонденсации. [45]
Страницы: 1 2 3 4