Растворимость - аргон
Cтраница 2
Подставляя в нее парциальные давления и растворимость аргона ( раАгге Аг) или метана ( раСН4ПаСБи) можно найти количества инертных газов, растворенных в жидком аммиаке. [16]
Ранее [1] опытным путем была определена растворимость аргона в водных растворах тетрасульфофталоцианинов кобальта, марганца и ванадия ( TSMePc; Me Co MnV) в температурном интервале 15 - 50 С. В настоящей работе с относительной погрешностью 0 3 % [2] определена растворимость кислорода в водных растворах тетрасульфофталоцианинов железа, марганца, никеля, кобальта при температурах 25 - 55 С, парциальном давлении газа 760 мм рт. ст. и концентрациях электролитов 0 - 5000 мг / л растворителя. [18]
На рис. 31 приведены изотермы зависимости растворимости аргона в водных растворах галогенидов тетраэтиламмония от природы галогенид-ионов. Максимум растворимости в водных растворах ( С2Н) 4МГ при переходе от J к Вг - и СП смещается в область больших добавок электролита. Данный факт можно объяснить тем, что наряду с усилением гидратации галогенид-ионов в ряду СП-Br - - J с ростом размеров ионов усиливается их разрушающее действие на структуру воды. Положение максимума определяется суммарным действием всех эффектов. В водных растворах хлорида и бромида тетраэтиламмония в отличие от иодидов максимум растворимости аргона наблюдается при всех изученных температурах [13], что обусловлено большей гидратацией и меньшим разрушающим действием хлорид - и бромид-ионов по сравнению с иодид-ионами. С повышением температуры высота максимума растворимости аргона во всех системах понижается. [19]
Принципиально новые явления обнаружены при изучении растворимости аргона в растворах хлорида и бромида тетраэтиламмония в этиленгликоле. [20]
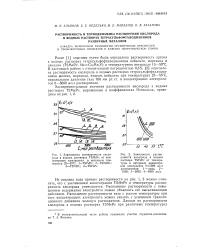
На рис. 30, а представлены зависимости растворимости аргона от концентрации соли в водных растворах иодида тетраметиламмония при температурах 273 - 298 К. Из рисунка видно, что при 273 - 288 К зависимости Csm f Xi) в районе Х2 6 Ю-4 проходят через максимум. [21]
На рис. 3 представлены зависимости концентрационных коэффициентов растворимости аргона от состава и температуры. При всех изученных температурах изотермы dCsm / 9X2 f ( X2) проходят через минимум. Причем с повышением температуры минимум смещается в область меньших добавок метанола, а глубина его уменьшается. [22]
Данные табл. 1 показывают, что расхождение между растворимостью аргона, вычисленной нами и [1], находятся в пределах ошибок опыта. [23]
Рассчитаны термодинамические характеристики процесса растворения газа по данным о растворимости аргона в водных растворах метанола. [24]
Подставляя в нее вместо Pa a парциальные давления и растворимость аргона ( РаАг и аДг) или метана ( Расн и а), можно найти количества инерт. [25]
На рис. 8, б представлены зависимости концентрационных коэффициентов растворимости аргона для системы Н20 - CH3CONH2 от состава при температурах 273 - 298 К. Причем с ростом температуры это действие ослабевает. Выше 293К значения 3Csm / dX2 практически не зависят от состава растворителя и близки к нулю. [26]
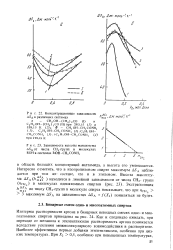 |
Зависимость высоты максимума Д дот числа СН2 - групп в молекулах ROH в системах R. QH-OLCONH. [27] |
Как и следовало ожидать, при переходе от метанола к этиленгликолю растворимость аргона понижается вследствие усиления межмолекулярного взаимодействия в растворителе. Наиболее эффективны первые добавки этиленгликоля, особенно при низких температурах. [28]
Анализ табл. 2 показывает, что с повышением концентрации добавок КС1 растворимость аргона при всех изученных концентрациях этилового спирта уменьшается, в то время как повышение концентрации С2Н5ОН при всех добавках электролита приводит к увеличению растворимости. [29]
Из табл. 1 видно, что с увеличением концентрации КВг и КОН растворимость аргона резко снижается, в случае же растворов HN03 это снижение незначительно. При всех составах растворителя значения у о с повышением температуры уменьшаются, причем наибольшее уменьшение наблюдается при первых добавках электролита и меньших температурах. [30]
Страницы: 1 2 3 4