Растворимость - аргон
Cтраница 3
С повышением температуры глубина минимума уменьшается и понижается эффективность действия добавок хлорида тетраэтиламмония на растворимость аргона. При Х2 0 04 наблюдается знакопеременность концентрационных коэффициентов. Зависимости bCsmj dX2 / ( AY) в системе С2Н4 ( OH) 2 - ( C2Hs) 4NBr симбатны рассмотренным. [31]
При температурах 283 - 298 К при переходе от метанола к ацетону ( рис. 14, а) растворимость аргона растет вследствие большей растворяющей способности второго компонента. При Т 313 328 К зависимости Csm f X2) проходят через минимум, причем с ростом температуры глубина минимума увеличивается и он смещается в область больших концентраций ацетона. Факт появления минимума растворимости газа на зависимостях Csm / №) при температурах, близких к температуре кипения растворителя, обнаружен впервые. [33]
Для системы метиловый спирт-этиловый спирт на кривых Csm f ( X2) при Х2 0 2 наблюдается минимум растворимости аргона. [34]
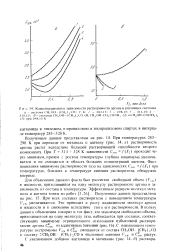
Из рис. 1 видно, что при 268 и 273 К и Х2 - 0 10 наблюдается максимум растворимости аргона, а при Т 278 К растворимость газа с увеличением добавок метилового спирта постоянно растет. Появление максимума растворимости можно объяснить конкурирующим влиянием эффекта гидрофобной и гидрофильной гидратации молекул метилового спирта [13-15]: до Х2 0 10 преобладает первый эффект, при Х2 0 10 - второй. С повышением температуры вследствие увеличения трансляционного движения молекул гидрофобная гидратация ослабевает, что приводит к уменьшению высоты максимума Csm при переходе от 268 к 273 Кик исчезновению его при более высоких температурах. При более высоких температурах минимум растворимости аргона отсутствует, что можно связать с преобладанием разрушающего действия температуры на структуру воды над стабилизирующим действием добавок метилового спирта. При Х2 0 18 при всех температурах растворимость газа с добавками метилового спирта растет вследствие большей растворяющей способности метанола. [35]
При добавлении к воде мочевины ( рис. 7, б), молекулы которой не имеют гидрофобных групп, растворимость аргона постоянно уменьшается, что, вероятно, связано с разрушением структуры воды с одновременным образованием ассоциатов между молекулами воды и мочевины. Данная интерпретация косвенно подтверждается монотонностью зависимостей dCsmlbXi f ( X2) ( рис. 8, в) и dCsm / dT f ( T) [13], хотя, как и во всех рассмотренных выше системах, действие первых добавок мочевины на растворимость аргона более эффективно. [36]
Некоторые трудности и расхождения, с которыми столкнулись Рэлей и Рамзай на ранней стадии исследований, стали понятны после изучения растворимости аргона в воде. При попытках выделить аргон сначала было трудно понять, почему исчезали небольшие количества газа. Это открытие натолкнуло их на мысль, что дождевая вода более обогащена аргоном, чем азотом. [37]
Данные о растворимости водорода, азота, аргона и метана в жидком аммиаке представлены на рис. VIII-8, из которого видно, что растворимость аргона в жидком аммиаке примерно в 2 раза, а метана в 3 5 раза больше растворимости водорода. [38]
Особый интерес при рассмотрении зависимостей Csm f ( X) для водных растворов иодидов тетраалкиламмония представляет, на наш взгляд, аномальное смещение максимума растворимости аргона с ростом размеров радикалов R. При переходе от ( СН3) 4 к ( С2Н5) 4М максимум смещается в область больших концентраций электролита, а при переходе от ( C2H5) 4N к ( C4H9) 4N - в область меньших концентраций соли. [39]
На рис. 5 приведены полученные нами изотермы растворимости кислорода в водных растворах н-пропилового и изопропилового спиртов при Х2 - 0 0 - г 0 10, а также растворимости аргона в системе вода-этанол. [40]
Из них следует, что зависимость Csm f ( X2) для водных растворов ацетона ( рис. 7, а) при Т 273 К имеет несколько иной характер чем для водных растворов одноатомных спиртов: с увеличением концентрации неэлектролита растворимость аргона постепенно растет. [41]
Все грунтовые воды, содержащие воздух, содержат также инертные газы. Растворимость аргона в воде несколько больше растворимости азота, поэтому, поданным Рэлея и Рамзая, отношение содержания аргона к содержанию азота в воде несколько больше, чем в воздухе. [42]
При концентрации спирта от 0 до - 0 1 мол. В этой области концентраций спирта растворимость аргона в системе Н2О - С2Н5ОН - КС1 увеличивается с повышением температуры. Области пересечения изотерм соответствует зона изораство-римости, которая служит границей перехода от водоподобной структуры к неводоподобной. [43]
В воде растворяются относительно большие количества инертных газов. Как следует из этих данных, растворимость аргона в воде даже несколько превышает растворимость кислорода. Растворимость инертных газов в органических растворителях в некоторых случаях превышает их растворимость в воде. При низких температурах активированный уголь более или менее энергично поглощает все инертные газы, за исключением гелия ( ср. В отличие от водорода гелий не диффундирует через раскаленную платину. Однако при повышенных температурах он ( как и водород) диффундирует через кварцевое стекло. [44]
В воде растворяются относительно большие количества инертных газов. Как следует из этих данных, растворимость аргона в воде даже несколько превышает растворимость кислорода. [45]
Страницы: 1 2 3 4