Растворимость - аргон
Cтраница 4
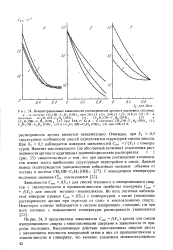
Для системы С2Н4 ( ОН) 2 - ( C2H5) 4NC1 при всех составах растворителя кривые Csm / ( Т) проходят через минимум ( см. главу I, рис. 1), причем с увеличением концентрации электролита до Х2 0 04 минимум смещается в область более высоких, а при Х2 0 04 в область более низких температур. В этой же последовательности составов глубина минимума растворимости аргона сначала возрастает, а затем уменьшается. Данные факты подтверждают высказанное выше предположение, что растворитель при X 0 04 наиболее структурирован, в связи с чем переход от механизма внедрения газа к сольваТационному механизму наблюдается при более высоких температурах. [46]
Широко распространено мнение, что имеется принципиальное различие в поведении водных и неводных растворов, в связи с чем используются такие термины, как в о до подобные и неводоподобные системы, а гидрофобный ( сольвофобный) эффект считается привилегией водных растворов. Вместе с тем исследования, проведенные нами по растворимости аргона в некоторых неводных растворителях ( этиленгликоль, пропилен-гликоль) [22] и в растворах галогенидов тетраэтиламмония в этиленгли-коле, показывают, что принципиальных различий в поведении таких систем нет. [47]
В настоящее время представляет интерес продолжить исследование по растворимости и термодинамическом поведении аргона в водных растворах других электролитов. С этой целью в данной работе нами изучена растворимость аргона в водных растворах бромида и гидроокиси калия, азотной кислоты, а также в системе Н2О - CgHsOH - КС1 в широком диапазоне температур ( 15 - 45 С) и концентраций. [48]
В пользу этого говорит уменьшение темпа роста растворимости газа в указанной области составов с повышением температуры. В интервале Х2 0 01 - ь 0 08 растворимость аргона меняется незначительно что, по-видимому, обусловлено проявлением гидрофильных свойств группы СО. При Х2 0 08 увеличение Csm определяется большей растворяющей способностью ацетона, чем воды. Изложенные выводы подтверждаются особенностями изотермы Csm f ( X2) при 268 К. Здесь, как и для водных растворов метилового спирта, наблюдаются максимум и минимум растворимости аргона, но менее ярко выраженные и сдвинутые в область меньших добавок неэлектролита. Несомненно, что причина их появления в обеих системах одна и та же. [49]
Иной характер имеют изотермы Csm / ( Х2) для смесей метилового спирта с к-пропанолом и н-бутанолом. В этих системах с увеличением содержания спирта с большими размерами алкильного радикала наблюдается постоянный рост растворимости аргона. Это является следствием проявления эффекта большей растворяющей способности второго компонента над эффектом усиления межмолекулярного взаимодействия с увеличением концентрации второго компонента. [50]
На рис. 1 у - коэффициент абсорбции Оствальда, выраженный в литрах газа на литр растворителя при нормальных условиях. Из рисунка видно, что с повышением концентрации тетрасульфофталоцианинов металлов в водном растворе и с увеличением температуры растворимость аргона значительно понижается. [51]
Зависимости Csm f X2) для смесей этилового и изопропилового спиртов с этиленгликолем и пропиленгликолем симбатны изотермам Csm f ( X2) для смесей метанол-этиленгликоль. Во всех системах наблюдается инверсия кривых Csm f ( X2) с температурой, а также уменьшение растворимости аргона при переходе от одно - к многоатомному спирту. [53]
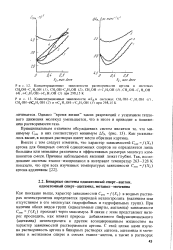 |
Концентрационные зависимости ДХАв системах СН3ОН - С2Н ОН ( /, СН3ОН - - С3Н7ОН ( 2 и / / - С3Н7ОН - / - СэН7ОН ( 3 при 298 15 К. [54] |
При наличии обоих видов групп ( одноатомные спирты, ацетамид) зависимости CSm - / №) проходят через максимум. В связи с этим представляет интерес проследить, как влияет природа добавляемого бифункционального ( ацетамид) неэлектролита к другим ассоциированным жидкостям на характер зависимостей растворимости аргона. [55]
Концентрационные коэффициенты растворимости при всех изученных температурах проходят через минимум ( рис. 8, а), смещающийся с повышением температуры в область больших добавок ацетона. Указанный факт, а также уменьшение численных значений dCsm / dX2 с ростом температуры указывает на то, что при повышении температуры влияние добавок ацетона на структуру воды и растворимость аргона менее эффективно. Зависимости Csm f ( X2) для системы вода-ацетамид ( рис. 7, б) симбатны изотермам Csm f ( X2) для водных растворов одноатомных спиртов: имеет место максимум растворимости аргона при Х2 0 005 и слабо выраженный минимум, смещающийся с повышением температуры в область меньших добавок неэлектролита. Причины появления максимума растворимости рассмотрены выше. Следует лишь отметить смещение максимума Csm в область меньших по сравнению с одноатомными спиртами концентраций неэлектролита. Это может быть объяснено более сильным разрушающим действием ацетамида на структуру воды за счет усиления гидрофильной гидратации. [56]
При добавлении к воде мочевины ( рис. 7, б), молекулы которой не имеют гидрофобных групп, растворимость аргона постоянно уменьшается, что, вероятно, связано с разрушением структуры воды с одновременным образованием ассоциатов между молекулами воды и мочевины. Данная интерпретация косвенно подтверждается монотонностью зависимостей dCsmlbXi f ( X2) ( рис. 8, в) и dCsm / dT f ( T) [13], хотя, как и во всех рассмотренных выше системах, действие первых добавок мочевины на растворимость аргона более эффективно. [57]
Страницы: 1 2 3 4