Растворимость - кристаллогидрат
Cтраница 1
Растворимость кристаллогидратов значительно выше растворимости безводного хромата кальция. Последний образуется при высоких температурах ( выше 400) и является наиболее устойчивым. [1]
Растворимость кристаллогидрата хлорида иттрия УСЬ - 7Н2О практически не зависит от температуры, что связано с почти нулевым тепловым эффектом его растворения. На кривой растворимости сульфата натрия имеется излом, соответствующий 32 4 С. До этой температуры насыщенный раствор находится в равновесии с осадком кристаллогидрата Na2S04 - ЮШО, выше ее-с безводной солью. Резкое изменение хода кривой растворимости сульфата натрия обусловлено значительной эндотермичностью процесса растворения кристаллогидрата и экзотермичностью растворения безводной соли. [2]
Растворимость кристаллогидрата хлорида иттрия YCb - 7HjO практически не зависит от температуры, что связано с почти нулевым тепловым эффектом его растворения. На кривой раствори мости сульфата натрия имеется излом, соответствующий 32 4 С. До этой температуры насыщенный раствор находится в равновесии с осадком кристаллогидрата Na3SO4 - 10HZ0, выше ее - с безводной солью. Резкое изменение хода кривой растворимости сульфата натрия обусловлено значительной эндотермичностью процесса растворения кристаллогидрата и экзотермичностью растворения безводной соли. [3]
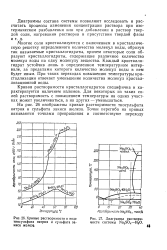 |
Кривые растворимости в воде тиосульфата натрия и сульфата закиси железа.| Диаграмма растворимости системы Маг5О4 - HSO. [4] |
Кривая растворимости кристаллогидратов специфична и характеризуется наличием изломов. Для некоторых из таких солей растворимость с повышением температуры на одних участках может увеличиваться, а на других - уменьшаться. [5]
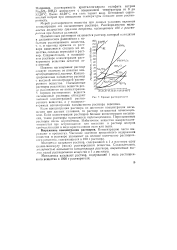 |
Кривые растворимости. [6] |
Например, растворимость кристаллогидрата сульфата натрия Na2SO4 - 10H2O возрастает с повышением температуры от 0 до 32 28 С. Выше 32 28 С эта соль теряет воду. Безводный сернокислый натрий при повышении температуры снижает свою растворимость. [7]
Однако зависимость растворимости кристаллогидратов сульфата тория от температуры иная, чем у церия. На рис. 30 приведены кривые, из которых видно, что при повышении температуры примерно до 45 С растворимость устойчивого девятивод-ного кристаллогидрата возрастает; при температурах выше 45 С устойчивой является четырехводная форма, растворимость которой при дальнейшем увеличении температуры уменьшается. [8]
При 30 С растворимость кристаллогидрата составляет 157 г в 100 г воды. Обезвоженная соль мало растворима в воде. [9]
Каждая ветвь отвечает растворимости определенного кристаллогидрата хлористого кальция, существующего в данном интервале температур. [10]
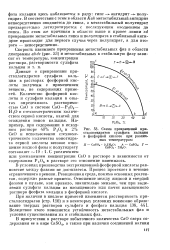 |
Схема превращений кристаллогидратов сульфата кальция в фосфорной кислоте при различных температурах. [11] |
При наличии в кислоте примесей изменяется растворимость кристаллогидратов ( стр. Вследствие этого изменяется устойчивость метастабильных фаз и условия существования их и стабильных фаз. [12]
Присутствие в кислоте примесей влияет на растворимость кристаллогидратов и в соответствии с этим изменяются устойчивость метастабильных фаз и условия сосуществования их и стабильных фаз. [13]
 |
Равновесие в системе Ca ( NO3 2 - HNO3 - H2O при 25. [14] |
Эти области ограничены кривой N MiMN растворимости кристаллогидратов в кислых растворах и линиями перехода кристаллогидратов. Ниже и левее линии растворимости находится область ненасыщенных кислых растворов. [15]
Страницы: 1 2 3 4