Растворимость - кристаллогидрат
Cтраница 4
G состава кристаллогидрата при температуре его плавления ( рис. 5.7) и опустить из этой точки перпендикуляр на ось абсцисс, то этот перпендикуляр GF разделит диаграмму на две части, аналогичные диаграмме на рис. 5.5. Линия НА по-прежнему является линией насыщения льдом, AGE - кривая растворимости кристаллогидрата состава F, и поэтому области AGR и GQE есть поля кристаллизации кристаллогидрата. В точке А кристаллизуется эвтектическая смесь льда и кристаллогидрата, а в точке Е - эвтектическая смесь кристаллогидрата F и безводной соли S. [46]
Линия ab разделяет области существования двух стабильных, а линия cd - двух метастабильных фаз. Ниже линии ab стабильной твердой фазой является гипс. Растворимость кристаллогидратов сульфата кальция в этой области уменьшается в следующей последовательности: полугидрат - ангидрит-типс. В соответствии с этим образующийся при кристаллизации мета-стабильный полугидрат переходит в ангидрит, который затем обводняется до гипса. При образовании ангидрита последний непосредственно переходит в гипс. [47]
Вначале рассчитывают количество исходных реактивов. Растворимость кристаллогидрата дихлорида олова, а также иодида калия составляет 130 г на 100 г воды. На основании этого определяют, сколько воды необходимо для приготовления концентрированных растворов дихяорида олова и иодида калия. После этого взвешивают нужные количества SnCl2 - 2H2O и KI, навески помещают в конические колбы и приливают расчетное количество дистиллированной воды до полного растворения солей. [48]
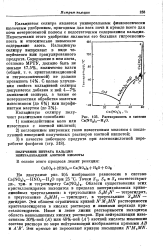 |
Растворимость в системе Ca ( N08 2 - H20. [49] |
На диаграмме рис. 104 изображено равновесие в системе Ca ( N08) z - HN03 - H20 при 25 С. Области существования этих кристаллогидратов находятся в пределах заштрихованных криволинейных треугольников: в треугольнике S M N - тетрагидрат, в треугольнике 83ММг - тригидрат, в треугольнике StMN - дигидрат. Эти области ограничены кривой N M MN растворимости кристаллогидратов в кислых растворах и линиями перехода кристаллогидратов. Ниже и левее линии растворимости находится область ненасыщенных кислых растворов. [50]
На диаграмме рис. 108 изображено равновесие в системе Ca ( NO3) 2 - HNO3 - Н2О при 25 С. Области существования этих кристаллогидратов находятся в пределах заштрихованных криволинейных треугольников: в треугольнике StMiN - тетрагидрат, в треугольнике S3MMi - тригидрат, в треугольнике S2MN - дигидрат. Эти области ограничены кривой N M MN растворимости кристаллогидратов в кислых растворах и линиями перехода кристаллогидратов. Ниже и левее линии растворимости находится область ненасыщенных кислых растворов. [51]
Кривая КВС является кривой растворимости сернокислого натрия. В точке В она имеет излом. Постепенный подъем этой кривой указывает на увеличение растворимости данного кристаллогидрата с ростом температуры. [52]
Основным фактором, определяющим скорость взаимодействия апатита с серной кислотой, является скорость диффузии иона Са2 через пограничный слой на поверхности зерна апатита. Так как концентрация Са2 в пограничном слое зависит от растворимости кристаллогидратов сульфатов кальция, то скорость разложения фосфатов будет возрастать в условиях, способствующих увеличению растворимости сульфата кальция. [53]
Примеси А12О3 и Fe2O3 способствуют уменьшению растворимости полугидрата. Растворимость ангидрита и полугидрата в растворах фосфорной кислоты существенно снижается в присутствии примесей магния. Достаточно сказать, что при содержании в фосфорной кислоте 2 % MgO растворимость кристаллогидратов снижается в несколько раз. [54]
Линия А К характеризует выделение кристаллов льда из растворов с малым содержанием соли. Кривая КВС является кривой растворимости сернокислого натрия. В точке В она имеет излом. Постепенный подъем этой кривой указывает на увеличение растворимости данного кристаллогидрата с ростом температуры. [55]
Страницы: 1 2 3 4