Растворимость - белок
Cтраница 2
Различия в растворимости белков послужили основой для классификации белков по группам [ 10а, 191 ], но в дальнейших исследованиях были обнаружены многие белки с промежуточной растворимостью ( например, псевдоглобулины), которые нелегко было отнести к какому-либо одному из установленных вначале классов. [16]
Хотя различия растворимости белков в тех или иных растворителях неоднократно использовались для их классификации, тем не менее ни одна из предложенных до сих пор схем классификации не может считаться достаточно удовлетворительной. Впервые фракционирование растворимых белков было произведено путем высаливания сернокислым аммонием. Фракция, осаждаемая сернокислым аммонием при полунасыщении раствора, была названа глобулином; фракция, осаждаемая сернокислым аммонием при более высоком проценте насыщения, получила название альбумина. Впоследствии было найдено, что фракция глобулина при диализе дает осадок, тогда как альбумин остается в растворе даже в отсутствие солей. В соответствии с этим глобулины определялись так же, как белки, растворимые в растворах нейтральных солей, но нерастворимые в чистой воде. В настоящее время мы, однако, знаем, что только некоторые из белков, входящих во фракцию глобулинов, так называемые эвглобулины нерастворимы в чистой воде, другие же белки этой фракции, так называемые псевдоглобулины, хорошо растворяются в чистой воде. Глобулиноподобные белки были выделены не только из животных тканей, но также и из семян злаков; некоторые из этих белков, так называемые проламины, растворимы в водном спирте. [17]
Как правило, растворимость белков уменьшается при понижении температуры. Если, однако, для высаливания используется сернокислый натрий, то понижение температуры ведет к повышению растворимости. Это объясняется тем, что при понижении температуры часть сернокислого натрия выпадает в осадок, вследствие чего концентрация его в растворе понижается. [18]
Большое значение для растворимости белка имеет концентрация электролита. Белки с ярко выраженным асимметрическим распределением заряда, как, например, сывороточные глобулины, требуют для растворения или стабилизации раствора определенной концентрации соли. Этот солевой эффект основан на снижении ассоциации или агрегапии белковых молекул, вызванном присоединением низкомолекулярных противоионов. Результатом являются повышенная гидратация и улучшение растворимости белка, его реассоциация при этом затруднена. Высаливание, ведущее к осаждению белка, основано на понижении гидратации белка за счет гидратации ионами электролита. Так как для различных белков необходима различная высаживающая концентрация электролита, высаливание относится к важным и удобным методам грубого фракционирования белков. [19]
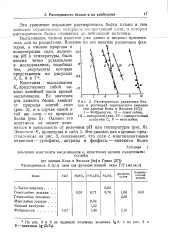 |
Растворимость различных белков в растворах сернокислого аммония. [20] |
Это уравнение выражает растворимость белка только в том довольно ограниченном интервале концентраций соли, з котором растворимость белка снижается до небольшой величины. [21]
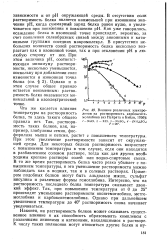 |
Влияние различных электролитов на растворимость карбоксиге-моглобина ( из Н. ейрата и Бэйли, 1956. [22] |
Наконец, на растворимость белков может оказывать существенное влияние и их способность образовывать комплексы с различными анионами и катионами, находящимися в растворе. [23]
Указанная разница в растворимости белков серого и белого вещества головного мозга несомненно отражает и различную роль, которую выполняют эти белки. [24]
При экспериментальном исследовании растворимости белка в систему обычно приходится вводить дополнительные компоненты - кислоты, основания или соли. Однако если контролировать состав системы по отношению к каждому из дополнительных компонентов и если в результате взаимодействия компонентов е образуется новых соединений, то система будет формально идентичной с описанной выше простой системой. В этой двухфазной системе состав раствора также остается постоянным независимо от соотношения объемов обеих фаз. Ниже термин растворитель применяется для обозначения как чистого вещества, так и раствора постоянного состава, поскольку с теоретической точки зрения применение каждого из них является эквивалентным. Серенсен и Хейруп [151] первыми установили, что при исследовании постоянства растворимости белка практически важно поддерживать неизменной концентрацию дополнительных компонентов, причем особенное внимание должно уделяться концентрации водородных ионов. [25]
Хорошо известно, что растворимость белков находится в тесной зависимости от рН и от концентрации солей в растворе. Минимум растворимости наблюдается при изоэлектрической точке. [26]
Относительное влияние солей на растворимость белка сходно с их влиянием на многие, хотя и не на все, физические свойства солевых растворов. Следовательно, способность солей менять растворимость белка может быть результатом изменения под их влиянием свойств растворителя. Главную роль в этом случае играет не столько непосредственное взаимодействие соли с белком, сколько взаимодействие между водой и солью. [27]
К От чего зависит растворимость белков. [28]
Очевидно, что снижение растворимости белков вблизи изо-электрической точки связано с минимальным значением суммарного заряда белковой молекулы в этих условиях и, следовательно, с понижением электростатических сил, препятствующих ассоциации одноименно заряженных молекул белка. [29]
Там, где это допускает растворимость белков, вместо пропанола для элюции можно использовать метанол в более высокой концентрации. [30]
Страницы: 1 2 3 4