Растворимость - белок
Cтраница 1
Растворимость белков имеет большое практическое значение, так как может быть применена для определения чистоты белковых веществ. [1]
Растворимость белков в воде варьирует в широких пределах. Одни белки легко растворяются в воде, не содержащей солей, другие, наоборот, растворяются только в воде, содержащей определенное количество солей; белки третьей группы нерастворимы в воде, но растворяются в смеси воды и спирта; белки четвертой группы - склеропротеины - не растворяются ни в каких растворителях. [2]
Растворимость белка зависит от отношения числа неполярных гидрофобных групп к числу полярных гидрофильных групп в молекуле, от их взаимного расположения и от результирующего дипольного момента. Заряженные полярные группы электростатически взаимодействуют друг с другом как внутри одной и той же молекулы, так и межмолекулярно, однако в воде эти силы благодаря высокой диэлектрической постоянной убывают и возникает повышающее растворимость взаимодействие между полярными группами и молекулами воды. Альбумины и псевдоглобулины очень легко растворимы в воде, так как в этом случае взаимодействие между белком и растворителем сильнее, чем взаимодействие между соседними молекулами белка. Эвгло-булины в воде нерастворимы, поскольку здесь более сильным является взаимодействие между молекулами белка. Добавление к воде такого растворителя как этиловый спирт снижает диэлектрическую постоянную и вместе с тем приводит к замене части молекул воды. Благодаря этому белки, очень хорошо растворимые в воде, в водно-спиртовых смесях растворяются гораздо хуже. Например, растворимость яичного альбумина или карбо-ксигемоглобина лошади [193] в 25 % - ном этиловом спирте при - 5 составляет всего лишь небольшую долю их растворимости в воде. При таких концентрациях этилового спирта денатурацию предотвращают хранением раствора при возможно более низкой температуре. [3]
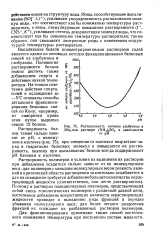
Растворимость белков также сильно зависит от рН, с минимумом в изоточке ( рис. 74); при смещении от изоточки возрастают заряд и гидратация белковых молекул и повышается их растворимость, поэтому при высаливании белков всегда поддерживают рН близким к изоточке. [4]
Растворимость белков обычно увеличивается с повышением температуры, если это повышение не вызывает денатурации. Однако нередко повышение температуры приводит к резкому уменьшению растворимости. Так, например, альдолаза мышц и карбоксигемоглобин человека при повышении температуры от 0 до 20 выпадают в кристаллическом виде. [5]
Растворимость белков обычно увеличивается с повышением температуры, если это повышение не вызывает денатурации. Однако нередко повышение температуры приводит к резкому уменьшению растворимости. Так, например альдолаза мышц и карбоксигемоглобин человека при повышении температуры от 0 до 20 выпадают в кристаллическом виде. [6]
Растворимости белков было посвящено много работ, так как растворимость различных белков является основой для их разделения и последующей очистки. [7]
 |
Растворимость яичного альбумина в. [8] |
Растворимость белков также сильно зависит от рН, с минимумом в изоточке ( рис. 75); при смещении от изоточки возрастают заряд и гидратация белковых молекул и повышается их растворимость, поэтому при высаливании белков всегда поддерживают рН близким к изоточке. [9]
Растворимость белков понижается с повышением концентрации нейтральных солей. [10]
Растворимость белков также различная. Некоторые из них почти нерастворимы ( например, белок коллаген, стр. [11]
Растворимость белка и способность к гидратации не зависят друг от друга. Так, коллаген связывает больше воды, чем сывороточный альбумин, но в отличие от последнего не растворяется в воде. Чтобы понять это внешнее несоответствие, необходимо вспомнить, что растворимость белка зависит от соотношения полярных и неполярных групп в молекуле, их взаимного расположения и от результирующего дипольного момента. Большое количество полярных группировок должно увеличивать как сродство белков к воде, так и их растворимость. Однако ионные группы могут оказывать и обратное действие, соединяясь с группировками противоположного знака и образуя внутри - и межмолекулярные солеобразные связи. Образование же таких межмолекулярных связей всегда ведет к дегидратации и способствует возникновению крупных нерастворимых агрегатов. [12]
Растворимость белков зависит от концентрации нейтральных солей в растворе, его рН и температуры. При этом соли оказывают двоякий эффект на растворимость. При низких концентрациях солей возрастание логарифма растворимости S прямо пропорционально ионной силе раствора, что обусловлено взаимодействием их ионов с заряженными группами белка, равно как и увеличением числа таких группировок. Вероятно, каждая из ионных групп окружается атмосферой солевых ионов противоположного знака. При достаточно высоких концентрациях солей большинство белков осаждается из водных растворов. [13]
Повышение растворимости белков в растворе нейтральных электролитов слабых концентраций может быть объяснено образованием соединений между ионом электролита и белка. [14]
Чтобы измерить растворимость белка, различные количества твердого белка вносятся. Эти пробирки полностью наполняют растворителем и закрывают. Воздух не допускается в пробирки из-за опасности поверхностной денатурации белка. Пробирки медленно вращаются, и раствор размешивается кусочками мрамора, помещенными в пробирки вместе с белком. Время перемешивания, необходимое для достижения равновесия при постоянной температуре бани, определяется на опыте. Затем растворы фильтруют и определяют количество белка в фильтрате. После этого вычерчивается зависимость количества белка в растворе от общего количества имеющегося белка. [15]
Страницы: 1 2 3 4