Электронодонорный растворитель
Cтраница 2
Льюиса, Бренстеда или их комбинация) и основания ( мономер, электронодонорный растворитель) определяют специфику процессов. [16]
Скорость процессов изомеризации и необратимой гибели активных центров понижается при переходе от электронодонорных растворителей к углеводородным [ 79, 142а ], при замене ароматических растворителей алифатическими [ 142а ], а также при переходе от RNa и RK к RLi [ 142, 142а ] и при понижении температуры. [17]
Смещение Яшах при образовании ассоциатов в ДЛИННОЕ о лновую-сторону, аналогично действию электронодонорных растворителей ( см. табл. 14) f указывало на значительную поляризацию связи Me-С в таких ассоциатах. [18]
Отметим малую вероятность реализации подобной схемы, так как она предусматривает, что электронодонорный растворитель в одинаковой степени сольватирует и электронодефицитный катион и анион-основание, причем последний к тому же координационно насыщен анионами галоида. [19]
При исследовании и обсуждении механизма гидроборирования необходимо учитывать резкое повышение скорости реакции в электронодонорных растворителях ( например, эфирах) по сравнению с реакцией в газовой фазе. [20]
Аналогична картина при сольватации катионов: маленькие, жесткие катионы высших степеней окисления сольватируются преимущественно жесткими электронодонорными растворителями ( Н2О, ОН), а большие мягкие катионы с меньшими зарядами лучше сольватируются мягкими диполярными апро-тонными донорньши растворителями. [21]
Исследованы ИК-спектры в области 3400 - 3100 ел-1 и 700 - 600 см-1 растворов н-бутилацетилена в электронодонорных растворителях. Описана конструкция температурной кюветы, позволившая получить спектры растворов при температуре от - 90 до 90 С. [22]
Шатенштейна в области теории кислот и оснований и донорно-акцепторного взаимодействия в последние годы нашли дальнейшее плодотворное приложение и развитие применительно к явлениям специфической сольватации катионов электронодонорными растворителями и анионов - протонодонорными растворителями. Таким образом, оказалось возможным регулировать скорости органических анионных реакций и выходы получающихся при этом продуктов. [23]
Это, разумеется, не может служить прямым доказательством образования бромоиневых ионов в реакции присоединения брома к двойной связи алкена в спирте, уксусной кислоте и других электронодонорных растворителях. [24]
Арил - и аралкилпроизводные щелочных металлов - АгМе - в большинстве случаев окрашенные твердые соединения, не растворяющиеся в инертных углеводородах, но растворяющиеся в диэтиловом эфире и других электронодонорных растворителях. [25]
С - константа равновесия при образовании комплексов н-бутилацетилен растворитель; ек, ем - интегральные коэффициенты поглощения полосы л ( -: СН) связанных и свободных молекул бутилацетилена; Св - концентрация электронодонорного растворителя с учетом изменения плотности раствора с температурой; Амс Ам Ас - интегральная интенсивность поглощения v ( CH) свободных молекул н-бутилацетилена; Ак - интегральная интенсивность поглощения vK ( CH) связанных Н - связью молекул бутилацетилена. [26]
Результаты исследований ( рис. 1) показывают, что применяемые основания Льюиса заметно влияют на состав получаемых сополимеров. Как электронодонорные растворители, основания Льюиса способны образовывать я-комплексы со свободными радикалами, что и приводит к уменьшению реакционной способности последних. [27]
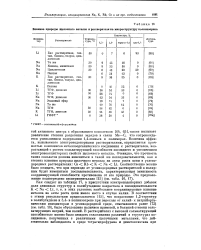 |
Влияние природы щелочного металла и растворителя на микроструктуру полиизопрена. [28] |
С, что сопровождается уменьшением содержания 1 4-звеньев в полимерах. Величина эффекта, вызываемого электронодонорными растворителями, определяется прочностью комплексов металлоорганического соединения с растворителем, возрастающей с ростом сольватирующей способности последнего и увеличением электроноакцепторных свойств щелочного металла. Очевидно, что прочность таких сольватов должна изменяться в такой же последовательности, как и степень влияния природы щелочного металла на акты роста цепи в углеводородных растворителях: Cs Rb; К Na Li. [29]
Хорошо известно, что эфир имеет тенденцию координироваться с протонами, давая оксониевые соединения, к чему не способны углеводороды. Поэтому если вести реакцию в электронодонорных растворителях, то протоны оказываются дополнительно и довольно прочно связанными с молекулами растворителя, в растворах же углеводородов они связаны, и при этом непрочно, только с атомами галоида. Из этого вытекает, что если фазой, определяющей общую скорость реакции присоединения, является воздействие электрофильного иона водорода на нуклеофильный олефин, то в электронодонорных растворителях скорость присоединения должка быть меньше, как это и оказалось на самом деле. [30]
Страницы: 1 2 3 4