Электронодонорный растворитель
Cтраница 3
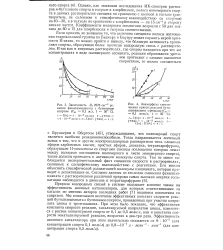 |
Зависимость Dt 2270 см-1 реакции фенилизоциаиата с бутиловым спиртом ( С 0 1 м / л, t 50 С.| Анаморфозы кинетических кривых реакций бути-лизоцианата с фенолом ( См 0 1 моль / л, t 50 С. [31] |
Брукнером и Обертсом [45], утверждающими, что полимерный спирт является наиболее реакционноспособным. Тогда напрашивается логичный вывод о том, что и другие электронодонорные растворители типа сложных эфиров карбоновых кислот, простых эфиров, диоксана, тетрагидрофурана, образующие Н - комплексы со спиртами ( полосы поглощения которых лежат между полосами поглощения полимерного и чисто мономерного спирта), также должны приводить к активации молекулы спирта. Тем не менее наблюдается экспериментальный факт снижения скорости в растворителях, склонных к специфическому взаимодействию с реагентами. Его можно объяснить специфической сольватацией молекулы изоцианата, которая приводит к дезактивации ее. [32]
Симбатно с ростом величин удерживания возрастает и теплота растворения вещества в электронодонорной жидкости В по сравнению с теплотой растворения в нейтральной жидкости. Понятно, что 500 - 800-кратное возрастание удерживания в электронодонорных растворителях по сравнению с инертным является таким же эффектом водородных связей, как и аномально высокая температура кипения ассоциированных жидкостей ( например, воды или формамида), а избыток соответствующих теп лот растворения аналогичен большим теплотам испарения этих жидкостей. На примерах гомологических рядов спиртов и ацетиленовых углеводородов демонстрируется падение экзальтации удерживания по мере роста неактивной углеводородной части молекул хроматографируе-мых веществ. Пример метанола показывает такое же падение величин удерживания по мере роста углеводородного балласта молекул растворителя. Заметим, что избыток молярной теплоты растворения, напротив, остается при этом приблизительно постоянным. [33]
Влияние стерических препятствий на взаимодействие экстрагируемое соединение - растворитель более существенно, чем на взаимодействие экстрагент - растворитель, поскольку в сольватации катиона обычно принимает участие несколько молекул растворителя. При этом важ-нэ, насколько стерически благоприятным является строение молекул электронодонорного растворителя [206] для образования соответствующего сольвата, а также насколько затрудняется взаимодействие объемистого соль-ватированного катиона с фенолят-ионом, обладающим для разных фенолов различными стерическими свойствами. [34]
Наиболее существенным взаимодействием экстрагируемого соединения с молекулами растворителя является сольватация. Поскольку сольватация анионов ( молекулами акцепторных растворителей) значительно слабее, чем сольватация катионов электронодонорными растворителями, взаимодействия экстрагируемых соединений обычно проявляются в системах с последними. [35]
Как следует из представленных в табл. 20 данных, доля АНН. СВ от АЯСП составляет от 45 % для системы индол - ацетонитрил до 56 % в случае наиболее сильного электронодонорного растворителя - гексаметилфосфортриамида. [36]
Присутствие нуклеофильных растворителей снижает активность иона Н и тем самым замедляет скорость реакции. Установлено, что галогеноводородная кислота очень быстро реагирует с алкеном в малоосновных растворителях ( ксилол, гептан) и значительно медленнее - в эфире или диоксане, являющимися электронодонорными растворителями. [37]
Рассмотрение известных катализаторов и различных схем инициирования предопределяет целесообразность общего подхода к инициированию процессов электрофильной полимеризации с позиций теории кислотно-основного взаимодействия. Подобные взаимодействия можно классифицировать как частный случай кислотно-основных взаимодействий в неводных средах, причем конкретная природа кислоты ( Льюиса, Бренстеда или их комбинация) и основания ( мономер, электронодонорный растворитель) определяют специфику процессов. [38]
Как отмечалось, процессы анионно-координационной и анионной полимеризации не всегда протекают по типу живущих полимеров. В ряде систем имеют место реакции обрыва реакционных цепей при их взаимодействии с протонодонорными соединениями или молекулами RX ( где X Cl, Br, J, ОН и др.), а также с гетероатомами электронодонорных растворителей. [39]
Таким образом, предпочтение следует отдать методам первой группы. Здесь проще всего достигается статистичность распределения мономеров вдоль цепи, реакции идут с высокой скоростью и технология процесса может быть удобно оформлена по непрерывному способу. Ниже более подробно рассмотрены два типа модификаторов: электронодонорные растворители и алкоголяты щелочных металлов. [40]
Кроме того, из-за малого сдвига полос поглощения связанных и свободных молекул часто приходится прибегать к процедуре разделения полос. Видимо поэтому среди большого числа работ [18], посвященных определению энергии Н - связи, крайне редки экспериментальные исследования систем с энергией порядка 1 - 2 икал / моль. Экспериментальные данные по энергии Н - связи между ацетиленовыми соединениями и электронодонорными растворителями исчерпываются двумя работами. Куркчи [21] методом хроматографии измерила теплоты растворения нескольких алкинов. [41]
Отметим, что особенно сильная чувствительность реакционной способности Cl-радикала к влиянию электронодонорных растворителей ( в данном случае я-доноров) связана, вероятно, со значительным сродством этого радикала к электрону. Например, значения энергии сродства к электрону таких радикалов, как СНз, СвН5О, НОз и С1, равны соответственно25 27 70 и 88 ккал / моль. Естественно, что в гемолитических реакциях с участием метильного или феноксильного радикалов влияние электронодонорных растворителей должно сказываться меньше, чем в реакциях хлорирования. [42]
Этот реагент выпускается промышленностью как в виде чистого препарата, так и в углеводородных растворах. Он реагирует с простыми эфи-рамн при повышенных температурах, однако восстановление органических соединений днизобутплалюмпннйгндрпдом в эфире, ТГФ или днглиме при низких температурах не представляет проблем. Диизобутилалюминпнгпдрнд является электрофнльным реагентом, и, следовательно, его реакционная способность может эффективно меняться за счет комплексообразовання с электронодонорными растворителями. Хотя дпюобутнлалюмнпнйгпдрпд менее хемосе-лектпвсн, чем ряд боранов или алкнлборогидрндов [8], во многих специфических случаях восстановления он является наиболее удобным реагентом. Ниже приведен краткий обзор реакции этого типа. [43]
Хорошо известно, что эфир имеет тенденцию координироваться с протонами, давая оксониевые соединения, к чему не способны углеводороды. Поэтому если вести реакцию в электронодонорных растворителях, то протоны оказываются дополнительно и довольно прочно связанными с молекулами растворителя, в растворах же углеводородов они связаны, и при этом непрочно, только с атомами галоида. Из этого вытекает, что если фазой, определяющей общую скорость реакции присоединения, является воздействие электрофильного иона водорода на нуклеофильный олефин, то в электронодонорных растворителях скорость присоединения должка быть меньше, как это и оказалось на самом деле. [44]
Комплексы первого типа термически неустойчивы и медленно разлагаются в атмосфере инертного газа даже при - 10 С. В твердом состоянии и в растворе они крайне чувствительны к свету. Напротив, фосфинозамещенные тер - мически устойчивы и не разлагаются при комнатной температуре в инертной атмосфере в течение нескольких месяцев. Они устойчивы также в растворе тетрагидрофурана, тогда как незамещенные производные гетеролитически расщепляются в слабо электронодонорных растворителях, выделяя соли гекса-карбонилметаллат-анионов. [45]
Страницы: 1 2 3 4