Связанный растворитель
Cтраница 3
Ранее одним из нас было показано [5], что в процессе распределения вещества между двумя растворителями, один из которых нанесен на носитель, в результате уменьшения растворяющей способности связанного растворителя из-за наличия в набухших гранулах носителя сольват-ного растворителя, не принимающего участия в процессе распределения, изменится и коэффициент распределения вещества между этими растворителями. Таким образом, для расчета процессов распределения в системах со связанными растворителями, а также их характеристики необходимо оперировать с коэффициентами распределения, определенными с учетом взаимодействия растворителя с носителем. Пренебрежение взаимодействием носителя с растворителем при рассмотрении процессов, протекающих в системах со связанными растворителями, приводит к существенным ошибкам. [31]
Бис ( N, Л / - дисалицилалэтилендиамин) - - акводикобальт - твердое вещество, коричневого цвета, микрокристаллического строения, немного растворимо в пиридине, хлороформе и бензоле. Это вещество выкристаллизовывается из пиридина и хлороформа в виде соответствующего сольвата; связанный растворитель, однако, удаляется при нагревании до 120 в вакууме, причем образуется вещество, обладающее несколько пониженной способностью поглощать кислород. В сухом состоянии поглощает кислород и тогда изменяет цвет от коричневого - до черного. При нагревании до 65 кислород выделяется снова. Бис ( N, W-ди-салицилалэтилендиамин) - у-акводикобальт абсорбирует также окись и двуокись азота, но необратимо. Окись углерода, двуокись серы и закись азота не поглощаются. В неоксидированном состоянии вещество парамагнитно, в оксидированном - диамагнитно. Вещество токсично, поэтому нужно избегать вдыхания его. [32]
Надо особо подчеркнуть, что оба образца - исследуемый и заведомо известный - должны быть приготовлены одним и тем же методом, а сравниваемые соединения должны находиться в одном и том же агрегатном состоянии. Нужно также учитывать возможность образования полиморфных модификаций и кристаллосольватов с различным количеством связанного растворителя, что очень характерно для углеводов. [33]
Процесс, образования сольватов сопровождается изменением внутренней энергии. Поэтому методы определения количества молекул низкомолекулярной жидкости, удерживаемых молекулами полимеров ( так называемый связанный растворитель), должны быть основаны на измерении физических величин, непосредственно связанных с энергией взаимодействия между молекулами. Такими величинами является теплота набухания, диэлектрическая проницаемость раствора, его сжимаемость. [34]
На основании изложенных выше работ в конце 30 - х годов сложились представления о сольватации в растворах полимеров, которые можно сформулировать следующим образом. Часть растворителя, имеющегося в растворе, прочно энергетически удерживается полимером, составляя сольватный слой, или связанный растворитель. Остальная часть растворителя удерживается полимером значительно слабее и составляет свободный растворитель. Следовательно, в полимерных растворах наблюдается то же самое явление, на которое обращал внимание еще Д. И. Менделеев, изучая водные растворы спирта и серной кислоты. [35]
Специфическая комбинация растворителя с высокомолекулярным веществом, вероятно, меняет удельный объем. Как объяснялось ранее, бх граммов растворителя, который образует часть гидродинамической частицы, включает в себя прочно связанный растворитель, а также растворитель, который связан менее прочно. Удельный объем их является средним для всего растворителя внутри частицы. [36]
Авторы [60] считают маловероятным образование свободных алкильных радикалов, так как получены лишь небольшие количества продуктов удвоения таких радикалов. Поэтому они предполагают, что гомолитический разрыв связи С-Mt ( уравнение ( П-9)) происходит при участии комплексно связанного растворителя. [37]
С повышением температуры суспензии за счет увеличения подвижности молекул растворителя и разветвлений макроструктуры частиц их эффективный объем резко уменьшается. С), когда резкое сокращение длины элементов макроструктуры и разрушение поверхностной двухмерной дисперсии лишает частицу основной массы подвижно связанного растворителя. И действительно ( рис. 166), температурный коэффициент вязкости суспензии сухого размола резко уменьшается во времени, а водного, наоборот, возрастает, причем абсолютные величины вязкости суспензий выравниваются и становятся наименьшими с приближением температуры к 60 С. [38]
Интегральные теплоты, очевидно, здесь не дадут ответа на наш вопрос. В самом деле, поскольку нас интересует характер связи между нитрогруп-пами нитроцеллюлозы и растворителем, нам необходимо установить не суммарную величину энергии сорбции и общее количество сорбированного вещества, а изменение сил адсорбционной связи по мере изменения количества связанного растворителя. [39]
Протонные спектры растворов А1 ( СЮ4) и А1С13 в ДМФ при комнатной температуре демонстируют отдельные сигналы ДМФ, находящегося в объеме растворителя и в координационной сфере, причиной чему - медленный обмен между этими двумя состояниями. Линии, относящиеся к ДМФ координационной сферы, не сдвигаются при введении в растворы А1 ( С104) 3 ионов С10 -, но введение в растворы А1С1 ионов С1 - - приводит к изменению резонансной частоты фор-мильных протонов связанного растворителя. [40]
 |
Результаты измерения скорости деформации и эффективной вязкости суспензий с различной вязкостью дисперсионной среды. [41] |
Аномалия вязкости растворов полимеров обусловливается особенностями макромолекул, а также образованием структур в растворе при увеличении концентрации полимера. Находящиеся в растворе свернутые в клубки макромолекулы всегда удерживают внутри себя некоторое количество растворителя. Наличие связанного растворителя приводит к увеличению размеров полимерных клубков-частиц и существенно влияет на вязкость системы. [42]
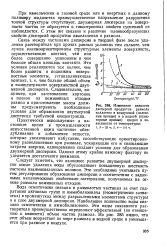 |
Изменение вязкости дисперсий продуктов размола коллагена в воздушной ( сплошные кривые и в водной ( пунктирные кривые средах в зависимости от температуры. [43] |
Вода осмотически связана в размолотых частицах за счет гидратации активных групп и иммобилизована ( ( геометрически захвачена) в промежутках между разрыхленными элементами структуры и в слое двухмерной дисперсии. Наибольшее количество воды связано осмотически и иммобилизовано. Эти виды связанного растворителя преимущественно определяют эффективный ( по отношению к вязкости) объем частиц размола. Из рис. 285 видно, что этот объем возрастает по мере размола в водной среде и уменьшается при размоле в воздухе. [44]
Растворы в хлорбензоле и в бромидах дали небольшие количества осадков и все внимание было уделено исследованию продуктов полимеризации фосфора в иодидах. Промытые и высушенные в вакууме, они представляли собой порошки цветом от темнофи-олетового в случае метил-иодида до оранжевого и желто-оранжевого в случаях более тяжелых органических радикалов. На 1 молекулу связанного растворителя ( считая по содержанию углерода) приходится, таким образом, от 25 до 40 атомов Р, а в большинстве случаев около 32 - 35 атомов. [45]
Страницы: 1 2 3 4