Значение - константа - диссоциация
Cтраница 2
 |
Экстракция бензоилацетонатов. [16] |
Значение константы диссоциации бензоилацетона - 8 7) близко к значению соответствующей константы ацетилацетона, но константы распределения бензоилацетона между органической и водной фазами значительно выше ( 660, 1150 и 2500 соответственно для четырех-хлористого углерода, бензола и хлороформа) [962], поэтому константы распределения нейтральных бензоилацето-натов значительно выше констант распределения соответствующих ацетилацетонатов. [17]
Значение константы диссоциации слабой кислоты характеризует равновесие процесса диссоциации независимо от концентрации кислоты в растворе. При заданной общей концентрации кислоты процесс диссоциации можно охарактеризовать по степени диссоциации, которая представляет собой отношение числа ( или концентрации) диссоциированных молекул к общему числу ( или концентрации) молекул кислоты в растворе. Степень диссоциации, конечно, зависит от концентрации. [18]
Значения констант диссоциации алкилкарбоновых кислот показывают, что приведенный в табл. 6 порядок изменения / - эффекта алкильных групп в основном верен. [19]
Значения констант диссоциации ионных пар ( точнее, изменения гиббсовых энергий) определяются электростатическими энергиями взаимодействия соответствующих противоположно заряженных ионов. Расстояния между ними равны сумме их кристаллографических радиусов, а диэлектрическая проницаемость принимается макроскопической. Кроме этой электростатической составляющей имеется еще универсальная ковалентная составляющая и соль-ватационный эффект, причем последний также может быть вычислен из простой электростатической модели взаимодействия между ионом и молекулой воды. [20]
Учитывая значения констант диссоциации HCN 5 - 10 - 10 и Д н2со3 4 - 10 - 7, рассмотреть, как влияет углекислый газ воздуха на водные растворы щелочных цианидов. Почему цианиды нужно хранить в плотно закрытых сосудах. [21]
Используя значение константы диссоциации фтористоводородной кислоты ( Кнр 5 37 1СГ4), определенное в 3 0-мол. [22]
Близость значений констант диссоциации ( & а1: а2 4 5) все же подсказывает, что и к этому результату надо подходить критически. [23]
Из значений констант диссоциации, приведенных в табл. 15, видно, что наиболее сильной является муравьиная кислота, а ее гомологи слабее. Это можно понять, приняв во внимание, что алкильные группы, обладая электроноотталкивающими свойствами, уменьшают заряд на атоме углерода карбоксильной группы и тем самым - его влияние на группу ОН. [24]
Из значений констант диссоциации, приведенных в табл. 15, видно, что наиболее сильной является муравьиная кислота. [25]
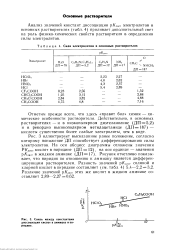 |
Сила электролитов в основных растворителях.| Связь между константами диссоциации кислот в аммиаке и пн-ридине. [26] |
Анализ значений констант диссоциации р / ( ДИсс электролитов в основных растворителях ( табл. 4) проливает дополнительный свет на роль физико-химических свойств растворителя в определении силы электролитов. [27]
Из значений константы диссоциации карбоновых кислот ( см. табл. 3.3) следует, что большинство их можно титровать раствором гидроксида натрия, не пользуясь никакими специальными условиями, реактивами или индикаторными устройствами. [28]
К - значение константы диссоциации в данный момент времени при данном значении а и при других фиксированных условиях в предположении, что на поверхности содержится один моль силаноль-ных групп. [29]
Вероятно, значения констант диссоциации, полученные с помощью современных измерений электропроводности [13], являются самыми точными. [30]
Страницы: 1 2 3 4