Расходование - исходное вещество
Cтраница 3
 |
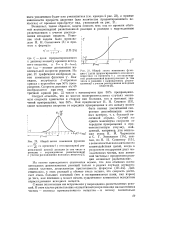
Диаграмма режима протекания цепной реакции. [31] |
Если концентрация свободных радикалов в системе остается постоянной во времени, то скорость процесса остается постоянной до полного расходования исходных веществ. Такой режим протекания цепной реакции называют стационарным. Если по ходу процесса концентрация свободных радикалов в системе увеличивается, то скорость процесса возрастает во времени и реакция может завершиться взрывом. Такой режим протекания цепной реакции называют автоу-окоряющимся. [32]
Реакциями продолжения цепи называются элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции. [33]
Лабильные промежуточные частицы вследствие малого количества, как правило, не оказывают влияния на количественную взаимосвязь между расходованием исходных веществ и накоплением продуктов реакции. Поэтому удобно при решении некоторых задач объединять несколько стадий реакции в одну, из которой исключены лабильные промежуточные частицы. Если такая частица образуется в одной стадии и расходуется в другой, то уравнения этих стадий можно сложить, получив в результате уравнение итогового процесса. [34]
Длина прямой цепи всегда конечна, а скорость образования начальных центров п0 может только убывать со временем вследствие расходования исходного вещества. [35]
Длина прямой цепи всегда конечна, а скорость образования начальных центров гс0 может только убывать со временем вследствие расходования исходного вещества. [36]
К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции. [37]
В такой расшифровке еще отсутствует вскрытие механизма, который приводит к точной взаимной компенсации между падением скорости, вызванным расходованием исходных веществ, и ростом скорости, обязанным увеличивающемуся разветвлению. Решение этой задачи возможно только при количественном рассмотрении соотношения между двумя указанными процессами, противоположными по своему влиянию на общую скорость окисления метана. Нам кажется, что несомненной заслугой авторов в этом вопросе является обоснованное экспериментом указание пути, на котором столь необычное кинетическое проявление реакции может получить свое объяснение. [38]
Если процессы, приводящие к стационарному уровню концентрации активных центров, достаточно быстры, так что стационарность устанавливается еще до заметного расходования исходных веществ ( или за счет самой цепной реакции, или просто за счет генерации носителей цепи), то фазу ускорения реакции можно - не рассматривать. Математическое описание скорости всего процесса в таком случае существенно упрощается. На ранних стадиях реакции особенно ценным является квазистационарное приближение для концентраций наиболее активных частиц. Стехиометрический анализ схемы реакции также упрощается, поскольку не надо учитывать большого числа промежуточных частиц с очень низкими концентрациями. В общие уравнения скорости изменения концентрации активных центров процессы обрыва цепей входят с отрицательным знаком и определяют характеристическое время выхода на режим квазистационарности. Характеристическое время жизни носителей цепи в любой момент времени равно отношению концентрации носителей к скорости обрыва. При относительно коротких характеристических временах жизни активных центров скорость протекания всего процесса стационарна. Если этого времени достаточно для того, чтобы активные центры с высокой вероятностью успели вступить в реакцию и произвести новые активные частицы, то цепная реакция проходит с большой эффективностью и характеризуется таким параметром, как длина цепи. Длина цепи определяется соотношением скоростей процессов продолжения и инициирования цепей. [39]
Возникает, таким образом, задача описать весь ход во времени обычной нестационарной разветвленной реакции и реакции с вырожденным разветвлением с учетом расходования исходных веществ. [41]
Для раздельного определения констант скоростей продолжения, зарождения и обрыва цепей необходимо наряду с данными по кинетике накопления продуктов реакции или по кинетике расходования исходных веществ располагать дополнительными данными. [42]
Для раздельного определения констант скорости продолжения, зарождения и обрыва цепей необходимо наряду с данными по кинетике накопления продуктов реакции или по кинетике расходования исходных веществ располагать дополнительными данными. [43]
Когда в некоторой последовательности реакций воспроизводится промежуточный продукт в виде свободного радикала, причем снова начинается этот ряд превращений, а вся совокупность стадий приводит к расходованию исходных веществ, то говорят, что такие реакции являются цепными. [44]
 |
Скорость прироста давления и концентрации ueo - СфНю, Og, GO, СС2 и СН по ходу окисления изобутана. Смесь 80 мм рт. ст. uso - CjHj0. [45] |
Страницы: 1 2 3 4