Значение - концентрация - компонент
Cтраница 1
Значение концентрации компонентов для величины буферной емкости объясняется тем, что соотношение [ кислота ]: [ соль ], от которого зависит рН буферной смеси, будет изменяться тем меньше при добавлении кислот и щелочей, чем выше значение числителя и знаменателя. Так, допустим, что имеются два ацетатных буфера, концентрация компонентов в которых составляет 10 и 100 мг-экв. [1]
Поскольку значения концентраций компонентов равновесия и ионных сил, вычисленные с помощью двух последних уравнений, практически совпадают, последнее решение можно считать правильным. [2]
При повышении температуры значения концентрации компонентов в обоих слоях изменяются, приближаясь друЬ к другу, однако каждой температуре соответствует определенная растворимость одной жидкости в другой, При критической температуре смешения составы обеих фаз выравниваются, граница раздела между ними исчезает и образуется гомогенный раствор. [3]
При повышении температуры значения концентраций компонентов в обеих фазах изменяются ( см. рис. 3.2), приближаясь друг к другу. При критической температуре смешения составы обеих фаз выравниваются, граница раздела между ними исчезает и образуется гомогенный раствор. Таким образом, предложенная теория описывает повышение растворимости полимера с ростом температуры: при температуре выше критической всегда имеется однофазный раствор любой концентрации. [4]
 |
Растворимость Na2SO4 в воде ( вес 96. [5] |
В первом случае значения концентраций компонентов не могут превышать определенной величины, и так как концентрация ком-понента не может быть отрицательной, соответствующие координатные оси конечны. Во втором случае концентрации отдельных компонентов могут возрасти до бесконечно большой величины и, стало быть, соответствующие координатные оси уходят в бесконечность. Как правило, для изображения температур и давлений применяются координатные оси, перпендикулярные многомерной плоскости, отображающей концентрации компонентов, в то время как последняя выражается отрезками как в прямоугольных, так и в косоугольных координатах. [6]
При повышении температуры значения концентрации компонентов в обоих слоях изменяются, приближаясь друг1 к другу, однако каждой температуре соответствует определенная растворимость одной жидкости в другой. При критической температуре смешения составы обеих фаз выравниваются, граница раздела между ними исчезает и образуется гомогенный раствор. [7]
При повышении температуры значения концентрации компонентов в обоих слоях изменяются, приближаясь друг - к другу, однако каждой температуре соответствует определенная растворимость одной жидкости в другой. При критической температуре смешения составы обеих фаз выравниваются, граница раздела между ними исчезает и образуется гомогенный раствор. [8]
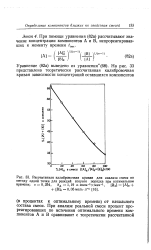 |
Рассчитанная калибровочная кривая для анализа смеси по. [9] |
При помощи уравнения ( 82а) рассчитывают значение концентрации компонентов А и В, непрореагировавших к моменту времени опт. [10]
Для определения L и S необходимо располагать значением концентрации компонента А в твердом остатке х, которая зависит от количества жидкой фазы L, захватываемой инертным компонентом. Для определения величины L можно использовать коэффициент захвата жидкой фазы инертным ( твердым) компонентом А3 ( см. разд. [11]
Для расчета градуировочного коэффициента методом абсолютной градуировки вводится значение концентрации сгр компонента в градуировочнои смеси и значение коэффициента, равное нулю. Для расчета концентрации необходимо вн. [12]
Следует отметить, что некоторые из приведенных в табл. 6.22 значений концентрации компонентов СОЖ превышают ПДК. Табличные уровни концентрации рассчитаны на обеспечение интенсивного процесса абразивной обработки в условиях замкнутой системы циркуляции СОЖ и герметизированных рабочих камер ( галтовочных барабанов, рабочих камер вибрационных станков и др.), что исключает возможность непосредственных контактов человека с СОЖ. [13]
По мере удаления в плоскости треугольника от вершины к противолежащей стороне значение концентрации компонента убывает и становится равным нулю. [14]
Так, достаточно задаться температурой и давлением системы, чтобы обусловить значения концентраций компонентов в равновесных паровой и жидкой фазах. [15]
Страницы: 1 2 3 4