Расчет - константа - равновесие
Cтраница 1
Расчет констант равновесия из ионообменных данных заключается в сопоставлении этих данных с теоретической кривой, полученной по известным величинам коэффициентов распределения. [1]
Расчет констант равновесия и составов равновесных смесей для гомогенных жидкофазных реакций или для взаимодействия газов с жидкостями представляет большой практический интерес, поскольку такие процессы часто встречаются в органической технологии. Эти расчеты имеют ряд особенностей по сравнению с расчетами газофазных реакций, что обусловлено спецификой жидкого состояния веществ и растворов. [2]
 |
Результаты расчетов степени накопления. [3] |
Расчеты константы равновесия этой реакции при различных концентрациях винной кислоты в растворе в условиях постоянства концентрации ионов меди ( II) и рН ( табл. 5.16) указывают на участие в этом равновесии одной молекулы винной кислоты. [4]
Расчет константы равновесия по приближенному уравнению (V.10) не всегда дает удовлетворительные результаты. [5]
Расчет константы равновесия с помощью этого выражения дает величину, достаточно хорошо согласующуюся со средними экспериментальными результатами. [6]
Расчет константы равновесия по приближенному уравнению (V.10) не всегда дает удовлетворительные результаты. [7]
Расчет констант равновесия при помощи функции F осложнен тем, что в уравнении (7.13) входят равновесные концентрации лиганда, которые неизвестны. Для вычисления [ LJ применяют метод последовательных приближений, предложенный Леденом. [8]
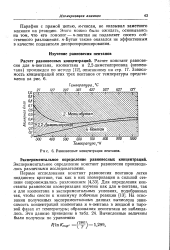 |
Равновесные концентрации пентанов. [9] |
Расчет констант равновесия для н-пентана, изопентана и 2 2-диметилпропана ( неопентана) произведен по методу [12], описанному на стр. [10]
Расчет констант равновесия при помощи функции F осложнен тем, что в уравнение ( VIII. Для вычисления равновесных концентраций применяют метод последовательных приближений Леде-на. [11]
Расчет константы равновесия по приближенному уравнению (V.10) не всегда дает удовлетворительные результаты. [12]
Расчет констант равновесия и равновесных составов основан на использовании уравнения, связывающего химический. [13]
Расчет константы равновесия проще всего выполнить, если предварительно оценить энтальпию и энтропию реакции. [14]
Расчеты констант равновесия, произведенные Сахановым и Тиличеевым 192 для реакций различных углеводородов, имеющих место при 477, показали, что нафтены стремятся дегидрироваться в производные бензола, а боковые цепи могут отщепляться с образованием олефинов. С точки зрения стойкости к термическому воздействию, нафтены занимают среднее положение между парафиновыми и ароматическими углеводородами. [15]
Страницы: 1 2 3 4