Расчет - константа - равновесие
Cтраница 2
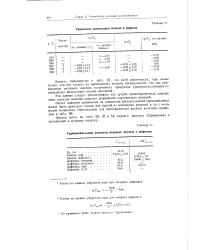 |
Термодинамические величины водорода, бензола и дифенила. [16] |
Расчет констант равновесия на основании третьего начала термодинамики может быть приведен только для первой из изученных реакций и то с очень малой точностью. [17]
Расчет констант равновесия различных процессов может быть проведен достаточно точно даже в тех случаях, когда не известны величины коэффициентов активности, для чего следует проводить исследование в достаточно разбавленных растворах. [18]
Расчет константы равновесия комплексообразования радикала I с водой дает значение 1 25 - lQ - 22 см3 / молекула ( 7 5 - Ю 2 л / моль) при 19 С. Энергия водородной связи, найденная из температурной зависимости константы равновесия, составляет 2 4 1 ккал / моль. Следовательно, энергия водородной связи при образовании сольватированных растворителем радикалов примерно равна энергии водородной связи, возникающей между двумя частицами, не имеющими неспаренные электроны. [19]
Поэтому расчет констант равновесия является важнейшей практической задачей химической термодинамики. Рассмотрим несколько примеров расчета выходов реакций по константам равновесия. [20]
Проведены расчеты констант равновесия, теплового эффекта, изменения свободной энергия, степени превращения и состава газовой смеси при температурах от 300 до 1500 К для реакций термического разложения метана, этана, пропана, бутана, пега-тана. Реакции частичного разложения углеводородов, по термодинамическим данным, заканчиваются при комнатной температуре, поэтому их степени превращения и составы газовых смесей не рассматриваются. [21]
 |
Равновесные массовые доли аммиака. [22] |
Проведем расчет константы равновесия данной реакции при повышенном давлении ( 30 МПа), приняв, что реакционная смесь является идеальным раствором реальных газов. [23]
Метод расчета константы равновесия К был дан в исключительно важном исследовании Д. В. Алексеева, Новые основания химической механики, Изв. [24]
Методы расчета констант равновесия рассматриваются в § И. [25]
Для расчета констант равновесия обычно применяют выражения, которые дают величины, легко сравнимые со случаем неупорядоченного обмена. [26]
Метод расчета констант равновесия из данных о нормальных ред-окс-потенциалах применим также и к определению возможности реакции дисмутации. [27]
Для расчета константы равновесия должны быть следующие данные: количества взятых веществ и суммарная концентрация кислоты в равновесной смеси. Ход расчета несколько различен для опытов по образованию этилацетата из спирта и уксусной кислоты и для опытов по омылению этого эфира водой. [28]
Для расчета констант равновесия могут быть использованы также потенциалы полуволн необратимых кинетических волн. Соответствующие уравнения рассмотрены в разд. [29]
Для расчета константы равновесия требуются следующие данные: количества взятых веществ и суммарная концентрация кислоты в равновесной смеси. Ход расчета различен для опытов по образованию этилацетата из спирта и уксусной кислоты и для опытов по омылению этого эфира водой. [30]
Страницы: 1 2 3 4