Расчет - константа - скорость - реакция
Cтраница 2
При проведении расчетов константы скорости реакции методом активированного комплекса определение статистических сумм не представляет затруднений. Определение же вращательных статистических сумм требует знания моментов инерции. Для вычисления моментов инерции необходимо иметь представление о конфигурации исходных частиц и активированного комплекса. Методов изучения активированного комплекса в настоящее время не существует. [16]
Получены уравнения для расчета константы скорости реакции и определены условия оптимального протекания процесса. [17]
Какое уравнение для расчета константы скорости реакции ( при низких давлениях) приводится в теории Гиншельвуда - Линдемана. [18]
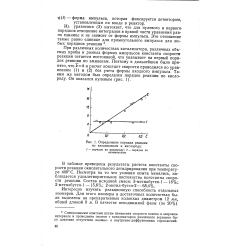 |
Определение порядка реакции. [19] |
В таблице приведены результаты расчета константы скорости реакции окислительного дегидрирования при температуре 400 С. Несмотря на то что условия опыта менялись, наблюдается удовлетворительное постоянство константы скорости реакции. [20]
Полученное выражение позволяет весьма просто производить расчет константы скорости реакции, если известно значение t мин для исследуемого процесса. Величину же t иин несложно определить экспериментально. По аналогии с этим и эффективность процессов смешения и диспергирования компонентов при получении смазочных материалов может однозначно определяться значениями t мин. Поэтому в качестве основного критерия эффективности процесса можно принять минимальное время обработки компонентов в ABC, при котором получается продукт необходимого качества и достигается максимальная производительность процесса. [21]
Следовательно, в таких случаях для расчета константы скорости реакции второго порядка необходимо знать молярную концентрацию фермента. [22]
В работе [ 1J был предложен алгоритм расчета констант скоростей реакций по экспериментальным данным, основанный на отыскании минимума функции невязки. [23]
Следует заметить, что имеющиеся уравнения для расчета константы скорости реакции термического разложения керогена получены А. Я. Аарна [4], Д. К. Коллеровым [5] и А. К. Митю-ревым [6] при сравнительно низких температурах - 275 - 420 С. Использование этих уравнений для температур 500 - 530 С является значительной экстраполяцией. [24]
Рассмотрим несколько фотохимических процессов, их механизм, расчет констант скоростей реакций. [25]
Такое совпадение оправдывает предположения, положенные в основу расчета констант скоростей реакций диспропорционирования радикалов. [26]
При внесении поправки на степень ионизации и при расчете константы скорости реакции с учетом концентрации лишь неионизированного вещества мнннмм константы скорости в 100 % - ной H2SO4 наблюдается и у других веществ. [27]
При изучении реакций в твердой фазе наблюдаются случаи, когда расчеты константы скорости реакции по общим формулам кинетики не дают постоянных значений. Это объясняется тем, что решающими факторами, определяющими скорость реакции, здесь являются не концентрации и не количества реагирующих веществ, а скорость диффузии последних через слой нового химического соединения, образовавшегося в результате реакции и разделяющего частицы реагирующих веществ. Поэтому расчет константы скорости реакции ведется по другим формулам. [28]
Хотя результаты [555] критикуются в работе [552, 553] с точки зрения расчетов констант скорости реакции ( на что дается ответ в статье [556], оспариваемый в статье [554]), по-видимому, колебания активности и трудности кинетических измерений вблизи равновесия и приводят к неопределенным и противоречивым результатам. Более правильным, вероятно, является значение пь 1, как следует из совокупности опытных данных по кинетике и механизму синтеза и разложения аммиака. [29]
Данные представляют в том же виде, как и для ФОРТРАН-программы расчета констант скорости реакций первого порядка. [30]
Страницы: 1 2 3 4