Расчет - константа - скорость - реакция
Cтраница 4
Полученные результаты приведены в таблице i. В этой же таблице приведены результаты расчета константы скорости реакции изомеризации 2 - ТБФ в 4 - ТБФ по реакции первого порядка. [46]
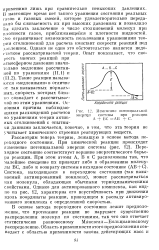 |
Изменение потенциальной. [47] |
В настоящее время пет такого уравнения состояния реальных газов и газовых смесей, которое удовлетворительно переда-ззало бы сжимаемость их при высоких давлениях и позволило бы сделать заключение о числе столкновений молекул при плотности газов, приближающейся к плотности жидкостей. Это ограничивает возможность пользования уравнениями теории столкновений для расчета констант скорости реакций под давлением. Однако не одно это обстоятельство является недостатком рассматриваемой теории. [48]
Уравнение (XV.2), связывающее скорость реакции с концентрациями реагирующих веществ, называется кинетическим уравнением. В зависимости от порядка реакции кинетические уравнения для расчета константы скорости реакции различны. [49]
Для определения порядка реакции был использован графический метод. На рис. 4 представлены зависимости величин, входящих в уравнение расчета константы скорости реакции для первого порядка. [50]
Углубление теоретических представлений о протекании органических реакций и о физическом смысле корреляционных уравнений типа строение - реакционная способность должно ослабить наблюдающийся в настоящее время дуализм в подходе к решению основной проблемы органической химии. Этот дуализм заключается в одновременном существовании полуэмпирических и основанных на квантовомеханических представлениях способов расчета констант скоростей реакций. [51]
Для полной характеристики основных особенностей системы нам необходимо обратить еще внимание на температурный ход селективности. Большое, можно сказать, преобладающее число лабораторных экспериментов8 показало, что с увеличением температуры селективность увеличивается. Расчет констант скорости реакции насыщения линолевых и олеиновых кислот, произведенный при предположении, что реакция подчиняется уравнению первого порядка, показывает, что скорости обеих реакций с увеличением температуры сближаются между собой. Можно было бы ожидать и такого соотношения, когда селективность не меняется с температурой. Это, по нашему мнению, должно иметь место при высоких давлениях, однако, в этих условиях явление селективности не подвергалось до сих пор исследованию. [52]
При изучении реакций в твердой фазе наблюдаются случаи, когда расчеты константы скорости реакции по общим формулам кинетики не дают постоянных значений. Это объясняется тем, что решающими факторами, определяющими скорость реакции, здесь являются не концентрации и не количества реагирующих веществ, а скорость диффузии последних через слой нового химического соединения, образовавшегося в результате реакции и разделяющего частицы реагирующих веществ. Поэтому расчет константы скорости реакции ведется по другим формулам. [53]
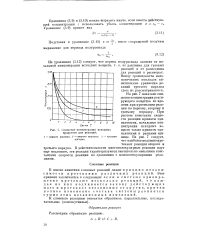 |
Снижение концентрации исходных продуктов для реакций. [54] |
Ввиду громоздкости математических выкладок кинетические уравнения реакций третьего порядка здесь не рассматриваются. На рис. 7 показано снижение концентрации реагирующего вещества во времени при протекании реакции по первому, второму и третьему порядку. При расчете константы скорости реакции приняты одинаковыми, начальные концентрации исходных веществ также приняты одинаковыми и равными единице. [55]
Страницы: 1 2 3 4