Расчет - коэффициент - активность
Cтраница 2
Для расчета коэффициентов активности по уравнениям ( 83) и ( 84) необходимо знать вторые вириальные коэффициенты индивидуальных веществ и их смесей. [16]
Для расчета коэффициента активности в концентрированных растворах, где уже нельзя пренебречь теплотой разбавления и ее зависимостью от температуры, необходимо знать парциальные мольные теплоемкости и энтальпии. [17]
Для расчета коэффициента активности и фугитивности широко используется теория соответственных состояний. При одинаковых приведенных температурах т и одинаковых приведенных давлениях я значения Y различных газов практически одинаковы ( с точностью примерно до 4 %), причем для Не, Н2 и Ne приходится пользоваться не действительными значениями их критической температуры 7к и критического давления рк, а вводить некоторую поправку. [18]
Для расчета коэффициентов активности можно применить рассмотренное в § 1 гл. [19]
Для расчета коэффициентов активности по уравнениям ( 83) и ( 84) необходимо знать вторые вириальные коэффициенты индивидуальных веществ и их смесей. [20]
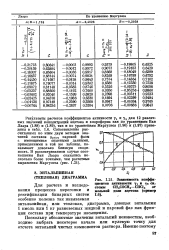 |
Зависимость коэффициентов активности Yi и Y си - стены СН3СОСН3 - СНС13 от мольной доли ацетона ( пример. [21] |
Результаты расчетов коэффициентов активности Vi и у2 для 12 различных значений концентраций ацетона и хлороформа как по уравнениям Ван Лаара (1.88) и (1.89), так и по уравнениям Маргулеса (1.96) и (1.97) приведены в табл. 1.6. Сопоставление рассчитанных по этим двум методам значений составов урасч паровой фазы с имеющимися опытными данными, приведенными в той же таблице, показывает довольно близкую сходимость. [22]
Для расчета коэффициентов активности компонентов в многокомпонентной смеси необходимо располагать числовыми значениями коэффициентов Ai - и составом жидкости. Коэффициенты AU учитывают межмолекулярное взаимодействие компонентов в бинарных смесях и определяются по опытным данным о равновесии между всевозможными парами компонентов в многокомпонентной смеси ( см. стр. Для системы, содержащей k компонентов, они образуют матрицу порядка k X k, причем диагональные элементы Аи равны нулю. [23]
Помимо расчета коэффициентов активности компонентов, а следовательно, фазовых равновесий жидкость - пар и жидкость - жидкость групповые модели растворов позволяют описывать и избыточную энтальпию растворов. [24]
Для расчета коэффициентов активности компонентов в многокомпонентной смеси необходимо располагать числовыми значениями коэффициентов Ац и составом жидкости. Коэффициенты А учитывают межмолекулярное взаимодействие компонентов в бинарных смесях и определяются по опытным данным о равновесии между всевозможными парами компонентов в многокомпонентной смеси ( см. стр. Для системы, содержащей k компонентов, они образуют матрицу порядка k X k, причем диагональные элементы А ц равны нулю. [25]
При расчете коэффициентов активности оказывают влияние не только погрешности определения составов равновесных фаз, но также погрешности измерения температуры или давления, так как в выражения для определения значений f входят, кроме составов фаз, давления паров компонентов при температуре кипения раствора и общее давление. Это затрудняет решение вопроса об источнике погрешности, вызывающем несоответствие экспериментальных данных уравнению Дюгема - Маргулеса. Методы, основанные на использовании этого уравнения, позволяют оценить термодинамическое соответствие данных в целом, практически не позволяя определить только точность данных о равновесных составах фаз, необходимых в первую очередь при расчете процесса ректификации. Другим недостатком этих методов является то, что операции графического дифференцирования или интегрирования, связанные с применением уравнения Дюгема - Маргулеса, трудоемки и точное их выполнение представляет определенные трудности. [26]
При расчете коэффициентов активности молекулярный вес растворенного вещества принят равным его формульному весу. [27]
При расчете коэффициентов активности по уравнению ( 6) удельный удерживаемый объем экстраполировали к бесконечно малому размеру образца. [28]
При расчете коэффициентов активности молекулярный вес растворенного вещества принят равным его формульному весу. [29]
При расчете коэффициентов активности водных растворов рекомендуется использовать уравнения Ван-Лаара, Вильсона, Цубоки - Катаямы, а также современные версии моделей групповых вкладов и др. Обращаем внимание на трудности в некоторых случаях корректного определения температурных зависимостей коэффициентов активности. [30]
Страницы: 1 2 3 4