Расчет - молекула
Cтраница 2
Начиная с первых основополагающих расчетов молекулы Н2, выполненных Гайтлером и Лондоном ( 1927), приближенные методы все более совершенствуются, так что в настоящее время экспериментальные и теоретические значения согласуются уже достаточно хорошо ( см. также часть II, гл. [16]
Соответственно при расчете молекулы этилена в валентный базис должны быть включены 12 АО. [17]
Сопоставим проведенный выше расчет молекулы LiH с аналогичным анализом молекулярных орбиталей HF. Для упрощения анализа предположим, что 25-орбиталь атома фтора является несвязывающей и содержит в основном состоянии два электрона. Это представляет собой обобщение приближения, сделанного для молекулы LiH, когда ls - орбиталь лития считали несвязывающей. [18]
Исходные данные для расчета молекулы могут быть записаны следующим образом. [19]
Было проведено несколько расчетов молекулы Н2 с учетом конфигурационного взаимодействия, которые дали для энергии диссоциации величину, отличающуюся от экспериментальной в пределах 0 2 эв. [20]
Отличие полученных из расчета молекулы СС12СН - СН2С1 частот, соответствующих С - С1 - колебаний ( ve и v10 - см. табл. 1) от v7 и v8 несколько превышают указанные границы. [21]
Покажем на примере расчета молекулы бутадиена, как при помощи метода ЛКАО - МО вычисляются основные параметры молекулы: энерг. [22]
При использовании для расчета молекул метода НДП применяются стандартные программы с заданными параметрами, в которых достаточно указать номера атомов по таблице Менделеева и их координаты в молекуле. Все вычиояения проводятся на ЭВМ. Поскольку стандартные программы не всегда применимы, они совершенствуются или изменяются в соответствии с конкретными задачами. [23]
Малликен применил к расчету молекул N2, O2, F2, CH4, С2Н6, С2Н4, С2Н2, а также ионов Н Не; и радикала СН. [24]
Большое значение приобретает развитие расчетов молекул на основе экспериментов с применением квантовой механики. Мы обладаем пока далеко не полными сведениями о строении молекул и твердых тел. Уста -; новление связей между строением и физическими, химическими, а во многих случаях и биологическими свойствами молекул и тел - вот важная очередная задача ученых. [25]
Гауссова орбиталь используется при расчетах молекул в качестве базисной функции для построения молекулярных орбиталей. [26]
Следующим шагом должен был быть расчет молекулы РЬ с помощью метода Рутана также с использованием в качестве базисного набора только двух ls - АО атомов водорода. [27]
Лен с сотрудниками [8] провели неполуэмпирический расчет молекулы азиридина. Геометрия молекулы азиридина была взята из экспериментальных данных. Была рассчитана полная энергия молекулы в зависимости от угла ( р, угла между плоскостью кольца и направления связи INH i а также высота энергетического барьера инверсии. [28]
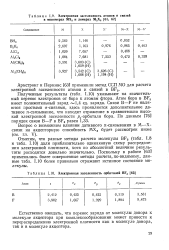 |
Электронная заселенность атомов и связей в мономерах МХ3 и димерах М2Хе.| Электронная заселенность орбиталей BF3. [29] |
Отметим, что разные методы расчета молекулы BF3 ( табл. 1.8 и табл. 1.10) дали приблизительно одинаковую схему распределения электронной плотности, хотя по абсолютной величине результаты расходятся довольно значительно. Поскольку в работе [63] применялись более совершенные методы расчета, по-видимому, данные табл. 1.10 более правильно отражают истинное состояние молекулы. [30]
Страницы: 1 2 3 4