Расчет - химический процесс
Cтраница 1
Расчет химического процесса по диффузионной модели более сложен, чем для моделей идеального смешения, идеального вытеснения и, ячеечной. [1]
Целью расчета химических процессов и аппаратов является определение массовых потоков перерабатываемых материалов, определение энергетических затрат, необходимых для осуществления процессов, и вычисление основных размеров машин и аппаратов. [2]
При расчете химического процесса в псевдоожиженном слое необходимо знать объемы, занимаемые твердыми частицами в каждой из. [3]
Основными целями расчета химических процессов и аппаратов являются определение весовых потоков перерабатываемых материалов, определение энергетических затрат, необходимых для осуществления процессов, и вычисление основных размеров машин и аппаратов. [4]
Поэтому при расчете промышленных химических процессов необходимо не только знать кинетику химических реакций, характеризующих микрокинетику процесса, но и учитывать макро-кинетические параметры, отражающие стохастику процесса в совокупности с детерминистической кинетикой, отражающей поведение системы в аппарате. [5]
Нернстом был предложен метод расчета равновесных химических процессов только по термическим данным, без экспериментального исследования равновесия. [6]
Применение методов химической термодинамики к расчету химических процессов практически всегда связано с использованием величин термодинамических функций ( энтропии, энтальпии, Ф - потенциала) при различных температурах в разных агрегатных состояниях. Для состояния идеального газа такие величины достаточно точно вычисляются методами статистической физики по молекулярным постоянным. В большинстве случаев эти методы доведены до практических рецептов. Однако при расчете многоатомных, сложных молекул их применение связано со значительно. [7]
Тепловой баланс служит основой при расчете тепловых и химических процессов. Для составления его необходимо определить количество тепла, вносимое в аппарат и уносимое из аппарата. [8]
Тепловой баланс служит основой при расчете тепловых, диффузионных и химических процессов. [9]
Теперь рассмотрим применение изложенной методики для расчета химических процессов в двухфазных системах. Здесь ftj и k2 - константы скорости реакции для сплошной и дисперсной фаз, пг - порядок реакции. [10]
Поэтому энтропию как критерий равновесия в расчетах химических процессов обычно не применяют, предпочитая пользоваться термодинамическими потенциалами. [11]
Для теплотехнических расчетов, а также для расчетов химических процессов, протекающих при постоянном давлении 1, необходимы сведения о двух термодинамических свойствах каждого вещества, принимающего участие в этих процессах: энтропии ST и энтальпии Нт. Для расчетов равновесия химических реакций, а также для определения равновесных составов, устанавливающихся в результате тех или иных процессов в исследуемой системе, необходимы также сведения о константах равновесия всех независимых химических реакций, возможных в данной системе. [12]
В книге изложены основы термодинамического анализа и расчетов химических процессов. [13]
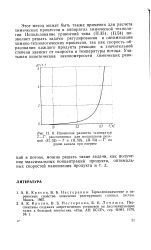 |
Изменение разности температур Т - Т, рассчитанных для механизмов реакций - Г и ( П. 52, ( II. 53 - Г по длине канала при нагреве. [14] |
Этот метод может быть также применен для расчета химических процессов в аппаратах химической технологии. Использование уравнений типа (11.35), (11.54) позволяет решать задачи регулирования и оптимизации химико-технологических процессов, так как скорость образования каждого продукта реакции в значительной степени зависит от скорости и температуры потока. [15]
Страницы: 1 2 3