Расчет - скорость - реакция
Cтраница 3
Рассмотрим, совпадут ли результаты расчетов скоростей реакции методом теории столкновений с результатами теории переходного состояния в случае, если реагируют не атомы, а молекулы. [31]
Возможность применения авнсния Эйринга для расчета скорости реакции зависит от воз -) Жности расчета функций распределения участвующих в реакции стиц. Обычно функции распределения могут быть рассчитаны и на основании Спектроскопических данных об энергетических ювнях, или путем использования различных приближенных вы-жений ( подразд. Действительная трудность состоит в ределении функций распределения активированного комплекса. [32]
Рассмотрим, совпадут ли результаты расчетов скоростей реакции методом теории столкновений с результатами теории переходного состояния в случае, если реагируют не атомы, а молекулы. [33]
Как применяется статистическая механика к расчету скоростей реакций в газах и какие допущения при этом делаются. Детальные математические выкладки не нужны. [34]
В настоящее время вряд ли возможен расчет скорости реакции для интересующих нас технических систем, хотя, конечно, эту задачу нельзя считать неразрешимой для науки вообще. [35]
Посмотрим, будут ли совпадать результаты расчетов скоростей реакции методом столкновений с результатами расчетов методом активного комплекса, если будут реагировать не атомы, а молекулы. Для этого упростим задачу, считая, что для каждого вида энергии сложной молекулы сумма состояний состоит из одинаковых множителей, по одному на каждую степень свободы. Обозначив поступательную, вращательную и колебательную суммы состояний на одну степень свободы соответственно через QHOCT. [36]
Во-вторых, было проведено значительное количество расчетов скоростей реакций с помощью методов, не включающих предположения о равновесии, и результаты всегда показывают хорошее соответствие с теорией Эйринга. В особенности следует упомянуть работу Слейтера [7] по мономолекулярным реакциям и некоторые другие [8] - по бимолекулярным. [37]
Как видно из изложенного, для расчета скорости реакции нужно учесть концентрацию частиц в данном интервале dl и скорость прохождения через этот интервал. [38]
Посмотрим, будут ли совпадать результаты расчетов скоростей реакции методом столкновений с результатами расчетов методов активного комплекса, если будут реагировать не атомы, а молекулы. Для этого упростим задачу, считая, что для каждого вида энергии сложной молекулы сумма состояний состоит из одинаковых множителей, по одному на каждую степень свободы. [39]
Для сравнения методов в применении к расчету скоростей реакций между двумя молекулами или молекулой и радикалом представим полные статистические суммы Z в виде произведений статистических сумм, осносящихся к отдельным степеням свободы. При этом для упрощения будем предполагать, что статистическая сумма для определенного вида движения имеет одно и то же значение как для каждой из исходных молекул ( радикалов), так и для активированного комплекса. [40]
 |
Определение энергии активации. [41] |
Это учитывается при более строгом подходе к расчету скорости реакции. [42]
Это учитывается при более стро-гом подходе к расчету скорости реакции. [43]
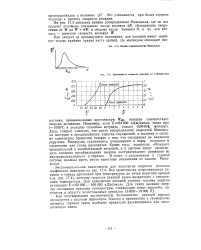 |
Кривая распределения Максвелла.| Зависимость скорости реакции от температуры. [44] |
Это учитывается при более строгом подходе к расчету скорости реакции. [45]
Страницы: 1 2 3