Расчет - равновесный состав
Cтраница 3
Для расчета равновесного состава системы, обладающей четырьмя степенями свободы и характеризующейся шестью переменными, необходимо дополнить соотношения ( 1 47) и ( 1 48) еще двумя условиями. Последние могут быть различными в зависимости от поставленной задачи. [31]
Для расчета равновесного состава паров по данным давления паров чистых компонентов следует применять закон Рауля. Согласно этому закону, парциальное давление компонента над раствором равно мольной доле этого компонента, умноженной на давление пара над этим Компонентом в чистом виде при температуре, равной температуре раствора. [32]
Для расчета равновесного состава паров на основе данных по давлению паров чистых компонентов следует применять закон Рауля. [33]
Для расчета равновесного состава смеси, в которой протекает сложная реакция, описываемая несколькими уравнениями, необходимо использовать стехиометрически независимые уравнения также, как при определении состава реагирующей смеси ( см. разд. Один из вариантов последовательности расчета, вытекающей из неоднозначности совпадения базисной системы с реально происходящими превращениями в смеси, рассмотрен ниже. [34]
Для расчета равновесных составов пара и жидкости используются допущения о постоянстве температуры и давления по высоте колонны и приближенные соотношения, соответствующие этому допущению. [35]
Методы расчета равновесного состава пара в бинарных системах при изотермических условиях по зависимости общего давления пара от состава раствора получили за последнее время широкое распространение, так как эти зависимости определяются экспериментально с большой степенью точности. [36]
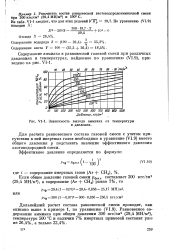 |
Зависимость выхода аммиака от температуры и давления. [37] |
Для расчета равновесного состава газовой смеси с учетом присутствия в ней инертных газов необходимо в уравнение (VI.9) вместо общего давления р подставить значение эффективного давления азотоводородной смеси. [38]
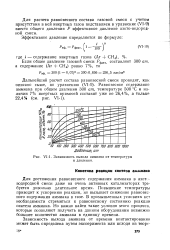 |
Зависимость выхода аммиака от температуры и давления. [39] |
Для расчета равновесного состава газовой смеси с учетом присутствия в ней инертных газов подставляем в уравнение ( VI-9) вместо общего давления Р эффективное давление азото-водород-ной смеси. [40]
Методика расчета равновесных составов газовых смесей по реакциям 1.1 и 1.7 заключается в следующем. [41]
Для расчета равновесных составов сложных смесей, устанавливающихся в системе в результате того или иного процесса, необходимы сведения о константах равновесия всех независимых реакций, возможных в данной системе. При составлении таблиц термодинамических свойств для большого круга веществ целесообразно вычислять константы равновесия всех соединений для одного из двух типов реакции: для реакций образования ( или диссоциации) этих соединений из элементов в стандартных состояниях или для реакций диссоциации на атомы. В первом случае существенным преимуществом является то, что тепловой эффект соответствующей реакции равен теплоте образования вещества из элементов в стандартном состоянии и не зависит от данных для других веществ. Однако использование констант равновесия такого типа в высокотемпературных расчетах, когда элементы находятся в состояниях, отличных от их стандартного состояния, требует дополнительных данных о давлении насыщенных паров таких элементов. [42]
Для расчета равновесного состава продуктов химической реакции, как мы видели, требуется знать значение константы равновесия, соответствующее условиям проведения реакции. [43]
При расчете равновесных составов, вообще говоря, нужно учитывать неидеальность системы. Однако при умеренных давлениях, обычно применяемых для синтеза ( до 5 МПа), летучести компонентов близки к парциальным давлениям и предположение об идеальности системы не вносит заметной ошибки в расчеты. [44]
При расчете равновесного состава необходимо учитывать следующие основные количественные законы: 1) материальный баланс, соблюдающийся при любых превращениях в закрытых системах; 2) условия равновесия. [45]
Страницы: 1 2 3 4