Расчет - теплота - реакция
Cтраница 1
Расчет теплоты реакции выполняется на основе закона Гесса по теплотам образования, сгорания компонентов в жидкой фазе. [1]
Результаты расчетов теплот реакций от этого не зависят, поскольку реагенты и продукты должны состоять из одного и того же числа атомов одинаковых элементов. [2]
Для расчетов теплот реакции уравнения ( II, 12) и ( II, 13) дол-жны быть проинтегрированы. [3]
Для расчетов теплот реакции уравнения ( II, 12) и ( II, 13) должны быть проинтегрированы. [4]
Почему при расчетах теплот реакций допустимо рассматривать стандартные теплоты образования веществ из элементов как абсолютные значения энтальпии этих веществ. Что происходит с элементами, входящими в левую часть всех уравнений, которым соответствуют табличные теплоты образования. Каким образом эти уравнения иллюстрируют закон сохранения массы. [5]
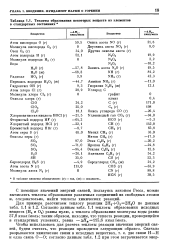 |
Теплоты образования некоторых веществ из элементов в стандартных состояниях. [6] |
Чтобы использовать для расчета теплоты реакции значения энергий связей, будем считать, что реакция проводится следующим образом. [7]
Таким образом, для расчета теплоты реакции при любой заданной температуре необходимо определять температурную зависимость теплоемкости всех компонентов реакции. [8]
Метод, основанный на расчете теплоты реакции по энергиям связей при равной достоверности, отличается сравнительной простотой и не требует очень подробных данных о химическом составе сырья и продуктов реакции. [9]
В качестве первого примера рассмотрим расчет теплоты реакции; при постоянном объеме и температуре 298 К, причем отметим, что экспериментальное измерение проведено при другой температуре. [10]
В качестве второго примера приведем расчет теплоты реакции при постоянном давлении, соответствующей какой-то температуре, если теплота реакции при 298 К известна. [11]
Большим, но неизбежным недостатком расчета теплот реакций по теплотам сгорания является уменьшение относительной точности получаемых результатов по сравнению с точностью исходных, данных. [12]
Большим, но неизбежным недостатком расчета теплот реакций по теплотам сгорания является уменьшение относительной точности получаемых результатов по сравнению с точностью исходных данных. [13]
В случае проведения реакции при повышенном давлении р расчет теплоты реакции Д г может быть выполнен следующим путем. [14]
В случае ионов металлов прямой путь определения или расчета теплоты реакции в газовой фазе отсутствует. [15]
Страницы: 1 2 3