Значение - атомная масса
Cтраница 1
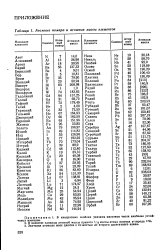 |
Атомные номера и атомные массы элементов. [1] |
Значения атомных масс даются с точностью до второго десятичного знака. [2]
Это значение атомной массы железа ( 55 8457) взято из работы, выполненной Бакстером и Гувером 50 лет назад. [3]
На основании значения химической атомной массы какого легкого элемента пришел ученый к этому выводу. [4]
Армстронг, принимая значение атомной массы урана 180, обязан был поставить его в IV группу с Ti и Zr вместо неоткрытого тогда гафния. [5]
Не обязательно следует брать значения атомных масс четырех элементов. Достаточно взять атомные массы двух соседних с ним элементов, расположенных справа и слева или сверху и снизу от него. [6]
На основе периодического закона были исправлены значения атомных масс некоторых элементов, а также уточнено представление о валентности некоторых элементов. [7]
В ячейках таблицы Менделеева рядом со знаком химического элемента указывают значение атомных масс его природных изотопов с учетом их распространения. [8]
Из этого правила следует важный вывод: четные элементы обычно имеют четное значение атомной массы. Нечетные ( по атомному номеру) элементы имеют нечетную массу ядер главных изотопов. [9]
В периодической системе, помещенной на обложке в начале книги, даны значения атомных масс в углеродной шкале. [10]
Число нейтронов в ядре атома элемента равно разности округленного до целого числа значения атомной массы Аг и числа протонов ( порядкового номера); значения А, и порядкового номера элементов приведены в Периодической системе элементов. [11]
 |
Атомные веса ( массы химических элементов по С. Канниццаро ( 1858 г. [12] |
Канниццаро была далеко не полной, но в ней ( за малым исключением для А1 и W) значения атомных масс элементов были точными. [13]
Причины расхождений значений атомных масс были различны. [14]
Близость к целым числам атомных масс элементов, представленных в природе одним изотопом, объясняется тем, что вся масса атома заключена в его ядре, а массы составляющих ядро протонов и нейтре-нов близки единице. В то же время значения атомных масс изотопов ( кроме 12С, масса которого принята равной 12 00000) никогда. Это объясняется рядом причин: небольшим отличием относительных масс протона и нейтрона от единицы ( соответственно 1 00727663 и 1 0086654), дефектом массы при образовании изотопа из нуклонов и электронов, незначительным вкладом в общую массу атома массы электронов: Масса электрона примерно в 1840 раз меньше массы нуклона. [15]
Страницы: 1 2 3