Расчет - энергия - диссоциация
Cтраница 1
Расчет энергии диссоциации р2 по значениям констант равновесия диссоциации фтора, найденным Уайзом [4298, 4299], и термодинамическими функциями F и р2, принятым в настоящем Справочнике, приводит к величине Do ( p2) 37 6 1 0 ккал / моль. Результаты двух измерений в опытах Уайза при наиболее высоких температурах заметно выпадают, что, вероятно, объясняется более энергичным взаимодействием фтора с материалом эффузионной ячейки. Если пренебречь этими двумя опытами, данные Уайза приводят к значению Do ( p2) 37 0 0 5 ккал / моль. [1]
Расчет энергии диссоциации молекулы может быть сделан и в тех случаях, когда слияния полос и их перехода в непрерывный спектр не наблюдается. Для этого вычисляют максимальную колебательную энергию, по которой определяют энергию диссоциации. [2]
Расчет энергии диссоциации молекулы Нг с функцией Гайтлера - Лондона дает 3 14 эв при равновесном расстоянии между ядрами, равном 0 87 А. Однако оба результата так далеки от экспериментальных значений ( 4 75 эв; 0 74 А), что трудно дать предпочтение одной из этих функций. [3]
Приведен расчет энергии диссоциации кластера. [4]
Во многих случаях расчет энергии диссоциации бывает значительно сложнее и требует знания самых различных термодинамических характеристик. [5]
Известен целый ряд расчетов энергий диссоциаций для различных типов связей, встречающихся в органических молекулах. Эти математические вычисления основываются частично на спектроскопических данных. Они весьма существенны при определении энергии активации, необходимой для вступления молекулы в химическую реакцию. Мы не будем разбирать здесь этот вопрос подробно. [6]
Вопрос о возможности расчета энергии диссоциации связи С-N в гексанитроэтане и энтальпии образования пентанитроэтильного радикала из термохимических величин рассматривается ниже, при обсуждении энергии связи С-С в гексанитроэтане. [7]
Основная неопределенность при расчете энергии диссоциации и определении закономерных изменений для них, как видно из изложенного выше, заключается в малой точности известных энтальпий образования радикалов, особенно более сложных, типа трет-бутила. [8]
По сравнению с задачей расчета энергий диссоциации двухатомных молекул теоретическое исследование связи в твердых телах с помощью кванто-во-механических принципов оказывается значительно более трудным - В принципе можно написать выражение для энергии сцепления [8] через посредство атомных волновых функций, но до настоящего времени результаты, имеющие термохимическую значимость, не были получены. [9]
 |
Энергии диссоциации молекул галогенов, найденные из спектроскопических и термохимических данных. [10] |
В табл. 5 приведены результаты расчетов энергии диссоциации для галогенов. [11]
 |
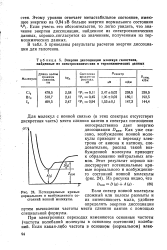
Потенциальные кривые нормального н возбужденного состояний ионной молекулы. [12] |
В табл. 5 приведены результаты расчетов энергии диссоциации для галогенов. [13]
В табл. III.6 приведены результаты расчетов энергии диссоциации и потенциала ионизации основного терма XS. Результаты, приведенные в таблице, впечатляющие. [14]
С другой стороны, для расчета энергии диссоциации С-N - связи в 2 2-динитропропане можно воспользоваться термохимическим расчетом, аналогичным расчету, выполненному для нитропроизводных метана. Эффект замещения водорода на нитрогруппу в 2-нитросоединениях ДЯ2 ( 1) составляет по нашей оценке 187 7 ккал / моль. [15]
Страницы: 1 2 3