Расщепление - орбиталь
Cтраница 2
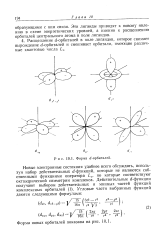 |
Форма d - орбиталей. [16] |
Эти лиганды приводят к новому явлению в схеме энергетических уровней, а именно к расщеплению орбиталей центрального атома в поле лигандов. [17]
Комплекс ( 17) имеет форму пирамиды с квадратом в основании, и расщепление его орбиталей подобно расщеплению орбиталей квадратного плоского комплекса. [18]
Теория поля лигандов в указанном выше смысле рассматривает два вопроса: 1) происхождение и 2) последствия расщепления внутренних орбиталей иона под действием его координационного окружения. [19]
Особенно сильное расщепление вызывают небольшие ионы с высоким зарядом. Благодаря расщеплению орбиталей меняется распределение электронов. Хотя в соответствии с правилом Гунда электроны стремятся занять каждый по орбитали, но под действием такого фактора, как электрический заряд, они все-таки вынуждены спариваться. В таком случае на орбиталях центрального атома освобождаются места для электронов лиганда. Теория кристаллического поля основное внимание уделяет электростатическому взаимодействию центрального иона и лиганда. Она оставляет в стороне изменение свойств лигандов под влиянием центрального атома и не учитывает перекрывание их орбиталей, а ведь фактическая связь в комплексах частично ковалентная. [20]
Как видно, энергия стабилизации в поле лигандов ( ЭСПЛ) - величина того же порядка, что и энергии обычных химических реакций. Поэтому эффект расщепления орбиталей должен оказывать заметное влияние на термодинамические свойства соединений переходных металлов. [21]
Они стремятся распределиться но всем доступным орбиталям и. Но посмотрим, что происходит при расщеплении орбиталей. У атома, находящегося в октаэдрическом окружении других атомов, как, например, в октаэдрических комплексах переходных металлов, пять d - орбиталей расщепляются на группу из трех орбиталей с более низкой энергией и группу из двух орбиталей с более высокой энергией. [23]
Действительно, плоскую конфигурацию можно рассматривать как предельно вытянутый вдоль одной оси октаэдр. Как видно из рис. 56 и данных табл. 25, расщепление высших орбиталей типа big и b2g в квадратных комплексах весьма велико. [24]
 |
Молекулярные термы окиси бериллия. [25] |
Рассматривая гра-фик, следует помнить, что 4т - и 1л - орби-тали уже являются молекулярными и связевыми и тут наблюдаются области перекрывания электронных облаков. Взаимное возмущающее их действие ведет к снятию вырождения и к расщеплению орбиталей. [26]
 |
Диаграмма энергетических уровней, иллюстрирующая расщепление пятикратно вырожденных d - орбиталей в октаэдрическом поле. [27] |
Трактовка на основании теории групп не дает ни абсолютную, ни относительную информацию об энергиях орбиталей. Энергетическую оценку можно получить другими методами, которые были указаны выше. Теория групп позволяет также установить расщепление орбиталей в поле других симметрии, таких, как Td ( тетраэдрическая), Dlft ( тетрагональная), D2d ( додекаэдриче-ская), D3fi ( тригонально-бипирамидальная), С4о ( квадратно - пира-мидальная), которые будут кратко рассмотрены ниже. [28]
В поле отрицательного или нейтрального полярного лиганда происходит расщепление орбиталей и их энергии изменяются. Характер расщепления зависит от симметрии образующегося комплексного соединения. На рис. 1.7 - 6 показано расщепление орбиталей в полях различной симметрии. Как видим, энергия некоторых орбиталей оказывается ниже энергии орбиталей в ионе - это связывающие орбитали комплексного соединения, а некоторые оказываются выше - это разрыхляющие орбитали комплексного соединения. Расстояние между расщепленными уровнями называют параметром расщепления полем лиганда Д, оно зависит от природы лиганда. [29]
 |
Образование я ( L - М - свя-зей в комплексе. [30] |
Страницы: 1 2 3
