Спин-орбитальное расщепление
Cтраница 1
 |
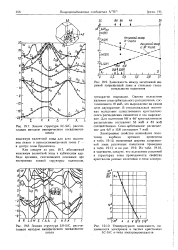
АО Эффективные массы носителей в соединениях типа. [1] |
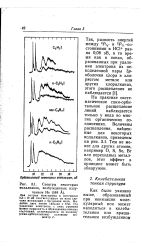
Спин-орбитальное расщепление в HgTe очень велико, и отделенная зона Г7 лежит на 1 эВ ниже Ге. [2]
Спин-орбитальное расщепление, вызванное взаимодействием магнитного поля при вращении электрона вокруг своей оси, с магнитным полем, создаваемым орбитальным движением электрона, смещает третью ветвь энергии на величину A. [3]
 |
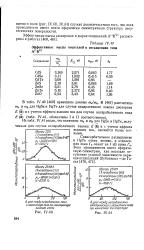
Межзонное и экситонное вращение плоскости поляризации. а-300 К. 6 - 77 К. У-ZnTe. 2 - CdSe. 3 - CdTe. 4 - CdTe0l6BSe0 05. [4] |
Спин-орбитальное расщепление энергетических зон непосредственно следует из его наличия для уровней энергии свободных атомов, образующих энергетические зоны при взаимодействии атомов друг с другом. Спин-орбитальное расщепление уровней энергии атомов в атомной физике и спектроскопии обычно называют тонкой структурой уровней и спектральных линий. [5]
Спин-орбитальное расщепление зон энергии, образованных из р-уровней, может быть только дублетным, чистые s - зоны не имеют спин-орбитального расщепления. В полупроводниках IV группы и в соединениях элементов типа A1HBV и AUBVI спин-орбитальное расщепление наблюдается для валентной зоны. При фиксированном элементе В величина расщепления остается практически постоянной. Это находится в хорошем соответствии со сказанным в § 26 о характере образования зон энергии соединений А У. [6]
Спин-орбитальное расщепление валентной зоны при k 0 экспериментально не наблюдалось; однако его можно грубо оценить исходя из величин расщепления р-функции атомов индия и сурьмы, которые равны соответственно 0 3 и 0 8 эв ( см. гл. Кэйн считает, что в антимониде индия валентный электрон 65 % времени проводит возле атома сурьмы; отсюда, согласно уравнению (2.3), для величины расщепления в кристаллах антимонида индия получается величина 0 9 эв. [7]
Спин-орбитальное расщепление основного состояния атомов элементов четвертой и шестой групп. [8]
Если спин-орбитальное расщепление велико, то необходимо проводить корреляцию между неприводимыми представлениями полной волновой функции, включающей спин. [9]
 |
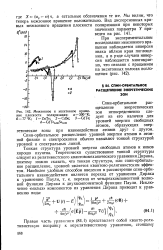
Схема линий рентгеноэлектронных спектров благородных газов, полученных ионизацией с различных атомных уровней. [10] |
Эффекты спин-орбитального расщепления, возбуждение рентгеновскими сателлитами и линии оже-спектра не изображены. Спин-орбитальные компоненты Ne2p и АгЗр в рентгеноэлектронных спектрах практически не разрешены, но линии 2Ру2 и 2Рз / 2 аргона с энергиями соответственно 250 6 и 248 5 эВ разрешаются. [11]
На практике систематическое спин-орбитальное расщепление линий наблюдается только у иода во многих органических соединениях. Величины расщепления, найденные для некоторых иодалканов, приведены на рис. 3.1. Тем не менее для других атомов, например О, S, Se, Вг или переходных металлов, этот эффект в принципе может быть обнаружен. [13]
Однако вследствие наличия спин-орбитального расщепления, составляющего 10 мэВ, это вырождение на самом деле двухкратное. В гексагональных политипах вследствие существования кристалличе-ского расщепления снимается и это вырождение. Для политипов 6Я и 4Я кристаллическое расщепление составляет 53 мэВ и 83 мэВ соответственно. [15]
Страницы: 1 2 3 4